solo per uso di ricerca
3-Methyladenine (3-MA) Inibitore di Autophagy/PI3K
N. Cat.S2767
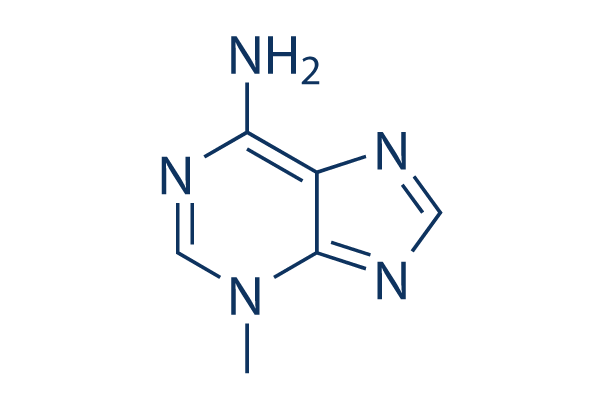
Struttura chimica
Peso molecolare: 149.15
Controllo Qualità
Prodotti spesso usati con 3-Methyladenine (3-MA)
| Target correlati | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Altro PI3K Inibitori | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 XL147 analogue Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) |
Coltura cellulare, trattamento e concentrazione di lavoro
| Linee cellulari | Tipo di saggio | Concentrazione | Tempo di incubazione | Formulazione | Descrizione dellattività | PMID |
|---|---|---|---|---|---|---|
| K562 | Function Assay | 10mM | 1h | decreases the expression of LC3-II and the formation of autophagosomes | 21864037 | |
| Jurkat | Function Assay | 10mM | 1h | decreases the expression of LC3-II and the formation of autophagosomes | 21864037 | |
| HeLa | Cytotoxicity Assay | 2mM | 24h | inhibites the cytotoxicity of silibinin to HeLa cells. | 21875385 | |
| PC12/TetOn | Function Assay | 0.1/1mM | 18h | leads to α-syn(WT) accumulation, toxicity, and oligomer formation | 21906659 | |
| RMPI8226 | Function Assay | 5mM | 1h | suppresses the level of autophagy under nutrient depletion | 21915620 | |
| MCF-7 | Function Assay | 10mM | 48h | blocks autophagy induced by bortezomib | 21931937 | |
| HBx | Apoptosis Assay | 10mM | 48h | DMSO | increases cell death | 22020078 |
| Marc-145 | Function Assay | 5mM | 12/24/36h | reduces the PRRSV titers and the protein expression | 22119900 | |
| U937 | Function Assay | 2mM | 12h | decreases the autophagy ratio | 22155150 | |
| BGC-823 | Function Assay | 5mM | 2h | inhibits the rate of autophagic cells | 22322152 | |
| A549 | Function Assay | 0.1mM | 24h | suppresses SU11274-induced cell death | 22466960 | |
| pDCs | Function Assay | 10mM | 0.5h | reduces the induction of IFN-α by ssRNA40 | 22396599 | |
| HeLa | Apoptosis Assay | 5mM | 24h | induces caspase-dependent cell death | 22545128 | |
| U251 | Apoptosis Assay | 5mM | 24h | increases S1-induced cell death | 22579788 | |
| MCF-7 | Apoptosis Assay | 0.1mM | 6h | enhances sirtinol-induced apoptosis | 22751989 | |
| PC-3 | Apoptosis Assay | 2mM | 2h | increases ORI-induced cell death | 22745580 | |
| HCT116 | Apoptosis Assay | 5mM | 24h | DMSO | enhances apigenin-induced cell death | 24626522 |
| U2OS | Growth Inhibition Assay | 10mM | 24h | intensifies the growth inhibition induced by Dox | 24639013 | |
| A2780cp | Apoptosis Assay | 2.5mM | 1h | ddH2O | enhances cisplatin-induced cell death | 24817946 |
| HepG2 | Function Assay | 5mM | 4h | increases cellular levels of HL | 24713587 | |
| Microglia | Apoptosis Assay | 5mM | 24h | decreases hypoxia-induced cell death | 24818601 | |
| MDA-MB 231 | Apoptosis Assay | 5mM | 0.5h | modulates Tocomin® induced apoptosis | 24830781 | |
| PANC-1 | Apoptosis Assay | 1mM | 48h | DMSO | enhances bortezomib-induced cell viability loss | 24842158 |
| MDA-MB-231 | Function Assay | 2mM | 48h | promotes TM-induced cell death | 24970676 | |
| MDA-MB-231 | Function Assay | 2mM | 24h | inhibits autophagy induced by TM | 24970676 | |
| MCF-7 | Function Assay | 2mM | 48h | promotes TM-induced cell death | 24970676 | |
| MCF-7 | Function Assay | 2mM | 24h | inhibits autophagy induced by TM | 24970676 | |
| HepG2 | Apoptosis Assay | 3mM | 5h | reduces cell apoptosis induced by QDs | 22836595 | |
| HeLa | Apoptosis Assay | 10mM | 2h | decreases cell viability co-treatment with PEI | 23000135 | |
| SK-HEP-1 | Apoptosis Assay | 10mM | 1h | protects against autophagy and induces apoptosis in bufalin-treated cells | 22858649 | |
| MDA-MB231 | Function Assay | 5mM | 1h | increases resveratrol-mediated caspase activation and cell death | 23088850 | |
| PaCa44 | Apoptosis Assay | 2.5mM | 1h | reduces genipin-mediated apoptosis | 23124112 | |
| T-47D | Function Assay | 10mM | 2h | inhibits autophagy process and increases rapamycin induced apoptosis | 23300026 | |
| GTL-16 | Apoptosis Assay | 5mM | 24h | reduces cell viability as compared to cells treated with MET inhibitors | 23313490 | |
| U251MG | Function Assay | 3mM | 1h | suppresses LC3-II protein expression | 23338618 | |
| T24 | Function Assay | 10mM | 1h | reduces the cleavage of LC3 after baicalin treatment | 23354080 | |
| HUVECs | Function Assay | 3mM | 24h | blocks the protective effect of resveratrol by inhibiting autophagy | 23358928 | |
| MCF-7 | Function Assay | 5mM | 24h | inhibits starvation-induced autophagy | 23395679 | |
| Hela | Function Assay | 5mM | 24h | inhibits starvation-induced autophagy | 23395679 | |
| OR6 | Function Assay | 10mM | 72h | suppresses HCV replication and formation of autophagosomes | 23395875 | |
| HT-29 | Function Assay | 1mM | 48/96h | inhibits AMPK induces autophagic cell death | 23508272 | |
| SH-SY5Y | Cytotoxicity Assay | 5mM | 24h | increases PCN toxicity | 23525265 | |
| Saos-2 | Apoptosis Assay | 1mM | 96h | increases cell death induced by PCX | 23563171 | |
| 1321N1 | Cytotoxicity Assay | 5mM | 24h | protects cell against PCN-induced toxicity | 23525265 | |
| A2780 | Apoptosis Assay | 5mM | 24h | converts FTY720 with CDDP into an additive effect towards killing ovarian cancer cells | 23592281 | |
| OV2008 | Apoptosis Assay | 5mM | 24h | converts FTY720 with CDDP into an additive effect towards killing ovarian cancer cells | 23592281 | |
| PC12 | Function Assay | 10mM | 24h | water | inhibits chymotrypsin-like proteasomal activity. | 23603979 |
| SH-SY5Y | Apoptosis Assay | 5mM | 1h | abolishes celastrol neuroprotective effect | 23619395 | |
| SH-SY5Y | Function Assay | 1mM | 24h | inhibits the autophagy induced by TOCP | 23743148 | |
| HepG2 | Function Assay | 10mM | 24h | inhibits siTIGAR- and HBSS-induced autophagy | 23817040 | |
| HeLa | Function Assay | 10mM | 2h | suppresses LC3 II expressison | 23864738 | |
| HONE-1 | Function Assay | 5mM | 1h | represses 6r-mediated ROS production | 23892358 | |
| MCF7 | Function Assay | 5mM | 24h | increases CuO induced cell death | 23962629 | |
| HO8910 | Apoptosis Assay | 10mM | 12h | enhances B19-induced apoptosi | 23983610 | |
| SMMC-7721 | Apoptosis Assay | 5mM | 24h | attenuates TNF-α protection against serum starvation-mediated apoptosis | 24066693 | |
| Hep3B | Apoptosis Assay | 5mM | 24h | attenuates TNF-α protection against serum starvation-mediated apoptosis | 24066693 | |
| H460 | Function Assay | 10mM | 4h | increases cisplatin-induced cell death | 24173208 | |
| A549 | Function Assay | 10mM | 4h | inhibits autophagy induced by irradiation | 24142735 | |
| H1299 | Function Assay | 10mM | 4h | increases cisplatin-induced cell death | 24173208 | |
| WiDr | Function Assay | 10mM | 1h | inhibits PCBL-induced LC3 II expression | 24190489 | |
| LoVo | Apoptosis Assay | 5mM | 48h | enhances DCA-induced apoptosis. | 24201812 | |
| HepG2 E47 | Function Assay | 2.5mM | 48h | increases the toxicity of AA, BSO, and CCl4 | 24273738 | |
| RKO | Function Assay | 2mM | 1h | DMSO | enhances cell death by geldanamycin | 24291777 |
| Hep3B | Apoptosis Assay | 2mM | 12h | DMSO | inhibits AZD8055-induced cell death | 24297300 |
| ACHN-5968 | Apoptosis Assay | 5mM | 3h | enhances paclitaxel-mediated apoptosis | 24305604 | |
| Huh7 | Apoptosis Assay | 2mM | 12h | DMSO | inhibits AZD8055-induced cell death | 24297300 |
| UOK257 | Apoptosis Assay | 5mM | 3h | enhances paclitaxel-mediated apoptosis | 24305604 | |
| ECSCs | Apoptosis Assay | 10mM | 4h | decreases rapamycin-treated apoptosis | 24319109 | |
| MCF-7 | Function Assay | 10mM | 24h | inhibits the autophagy induced by chemotherapy drugs | 24315578 | |
| SGC-7901 | Apoptosis Assay | 2mM | 1h | increases CA-4 induced apoptosis | 24321340 | |
| SMMC-7721 | Apoptosis Assay | 2mM | 1h | increases CA-4 induced apoptosis | 24321340 | |
| T24 | Apoptosis Assay | 5mM | 1.5h | potentiates celecoxib-induced apoptosis | 24349176 | |
| NTUB1 | Apoptosis Assay | 5mM | 1.5h | potentiates celecoxib-induced apoptosis | 24349176 | |
| MG-63 | Apoptosis Assay | 10mM | 12h | enhances DP-induced apoptosis | 24358301 | |
| MG-63 | Apoptosis Assay | 0.5/1mM | 32h | enhances salinomycin-induced cell apoptosis | 24358342 | |
| MG-63 | Function Assay | 0.5/1mM | 48h | induces salinomycin-induced cell viability loss | 24358342 | |
| U2OS | Function Assay | 0.5/1mM | 48h | induces salinomycin-induced cell viability loss | 24358342 | |
| HGC-27 | Function Assay | 10mM | 1h | inhibits the cell viability loss by RAD001 or MK-2206 | 24416349 | |
| HCT116 | Apoptosis Assay | 5mM | 24h | enhances the apoptosis induced by apigenin | 24626522 | |
| A549 | Apoptosis Assay | 10mM | 48h | accelerates the reduction of cell viability induced by PTX | 24626722 | |
| Saos-2 | Apoptosis Assay | 10mM | 24h | intensifies the growth inhibition of the U2OS cells induced by Dox | 24639013 | |
| U2OS | Apoptosis Assay | 10mM | 24h | intensifies the growth inhibition of the U2OS cells induced by Dox | 24639013 | |
| HepG2 | Function Assay | 5mM | 4h | increases HL release | 24713587 | |
| A549 | Apoptosis Assay | 5mM | 48h | decreases the percentage of cell death and expression levels of caspase-3, Beclin-1 and LC3-II | 24706303 | |
| A2780cp | Apoptosis Assay | 2.5mM | 1h | ddH2O | enhances cisplatin-induced cell death | 24817946 |
| Microglia | Apoptosis Assay | 5mM | 24h | decreases hypoxia-induced cell death | 24818601 | |
| HT-29 | Apoptosis Assay | 1mM | 48h | DMSO | enhances bortezomib-induced cell viability loss | 24842158 |
| MDR | Apoptosis Assay | 10mM | 6h | strengthens the power of anticancer drugs | 25019701 | |
| H157 | Function Assay | 5mM | 2h | suppresses SPC induced accumulation of LC3-II | 25285628 | |
| A549 | Function Assay | 5mM | 2h | suppresses SPC induced accumulation of LC3-II | 25285628 | |
| A2780cp | Growth Inhibition Assay | 1mM | 1h | increases cisplatin-induced cell death | 25322694 | |
| NBL-W-S | Apoptosis Assay | 1mM | 6h | increases cell apoptosis induced by GANT-61 | 25323222 | |
| NBL-W-S | Growth Inhibition Assay | 1mM | 6h | enhances GANT-61 toxicity | 25323222 | |
| A549 | Apoptosis Assay | 5mM | 2h | DMSO | inhibits BDMC-induced apoptotic cell death | 25716561 |
| 95D | Apoptosis Assay | 5mM | 2h | DMSO | inhibits BDMC-induced apoptotic cell death | 25716561 |
| A549 | Growth Inhibition Assay | 3mM | 2h | DMSO | reduces growth inhibitory effect of BDMC | 25716561 |
| 95D | Growth Inhibition Assay | 3mM | 2h | DMSO | reduces growth inhibitory effect of BDMC | 25716561 |
| Nara-H | Growth Inhibition Assay | 5mM | 48h | enhances temsirolimusmediated suppression of Nara-H cell proliferation | 21805033 | |
| HUVECs | Function Assay | 10mM | 0.5h | decreases the AGE-BSAinduced autophagy leve | 21468592 | |
| HepG2 | Apoptosis Assay | 2mM | 1h | enhances radiation-induced cell death | 21453691 | |
| U-2 OS | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for U-2 OS cells | 29435139 | |||
| A673 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for A673 cells | 29435139 | |||
| DAOY | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for DAOY cells | 29435139 | |||
| Saos-2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Saos-2 cells | 29435139 | |||
| BT-37 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-37 cells | 29435139 | |||
| RD | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for RD cells | 29435139 | |||
| SK-N-SH | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-SH cells | 29435139 | |||
| BT-12 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-12 cells | 29435139 | |||
| MG 63 (6-TG R) | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for MG 63 (6-TG R) cells | 29435139 | |||
| NB1643 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB1643 cells | 29435139 | |||
| OHS-50 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for OHS-50 cells | 29435139 | |||
| Rh41 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh41 cells | 29435139 | |||
| Rh30 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh30 cells | 29435139 | |||
| SJ-GBM2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SJ-GBM2 cells | 29435139 | |||
| SK-N-MC | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-MC cells | 29435139 | |||
| NB-EBc1 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB-EBc1 cells | 29435139 | |||
| LAN-5 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for LAN-5 cells | 29435139 | |||
| Rh18 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh18 cells | 29435139 | |||
| Clicca per visualizzare più dati sperimentali sulle linee cellulari | ||||||
Informazioni chimiche, conservazione e stabilità
| Peso molecolare | 149.15 | Formula | C6H7N5 |
Conservazione (Dalla data di ricezione) | 3 years -20°C powder |
|---|---|---|---|---|---|
| N. CAS | 5142-23-4 | Scarica SDF | Conservazione delle soluzioni stock | Le soluzioni sono instabili. Preparare al momento o acquistare formati piccoli e preconfezionati. Riconfezionare al ricevimento. | |
| Sinonimi | NSC 66389 | Smiles | CN1C=NC(=N)C2=C1N=CN2 | ||
Solubilità
|
In vitro |
DMSO
: 10 mg/mL
(67.04 mM)
Riscaldato con bagno dacqua a 50°C;
Sonicato;
Ethanol : 10 mg/mL Water : 4 mg/mL |
Calcolatore di Molarità
|
In vivo |
|||||
Calcolatore di formulazione in vivo (Soluzione chiara)
Passo 1: Inserire le informazioni di seguito (Consigliato: Un animale aggiuntivo per tenere conto della perdita durante lesperimento)
Passo 2: Inserire la formulazione in vivo (Questo è solo il calcolatore, non la formulazione. Contattateci prima se non cè una formulazione in vivo nella sezione Solubilità.)
Risultati del calcolo:
Concentrazione di lavoro: mg/ml;
Metodo per preparare il liquido master di DMSO: mg farmaco predissolto in μL DMSO ( Concentrazione del liquido master mg/mL, Vi preghiamo di contattarci prima se la concentrazione supera la solubilità del DMSO del lotto del farmaco. )
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungereμL PEG300, mescolare e chiarire, quindi aggiungereμL Tween 80, mescolare e chiarire, quindi aggiungere μL ddH2O, mescolare e chiarire.
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungere μL Olio di mais, mescolare e chiarire.
Nota: 1. Si prega di assicurarsi che il liquido sia limpido prima di aggiungere il solvente successivo.
2. Assicurarsi di aggiungere il/i solvente/i in ordine. È necessario assicurarsi che la soluzione ottenuta, nellaggiunta precedente, sia una soluzione limpida prima di procedere allaggiunta del solvente successivo. Metodi fisici come il vortex, gli ultrasuoni o il bagno dacqua calda possono essere utilizzati per facilitare la dissoluzione.
Meccanismo dazione
| Targets/IC50/Ki |
Autophagy
Vps34
(HeLa cells) 25 μM
PI3Kγ
(HeLa cells) 60 μM
|
|---|---|
| In vitro |
La leggera preferenza per la prevenzione di Vps34 da parte della 3-Methyladenine (3-MA) deriva probabilmente da un anello idrofobico specifico di Vps34, che circonda il gruppo 3-metile di questo composto. È stato riportato che causa la morte delle cellule tumorali sia in condizioni normali che di fame, e potrebbe anche sopprimere la migrazione e l'invasione cellulare indipendentemente dalla sua capacità di inibire l'Autophagy, implicando che possiede funzioni diverse dalla soppressione dell'Autophagy. Questo composto induce la morte cellulare caspasi-dipendente che è indipendente dall'inibizione dell'Autophagy. Il trattamento con 5 mM di esso riduce la percentuale di cellule HeLa private di glucosio che mostrano punti GFP-LC3 al 23%. I livelli di LC3-I aumentano e i livelli di LC3-II diminuiscono tra 12 e 48 ore nelle cellule trattate con 3-MA. La conversione di LC3-I in LC3-II è soppressa dal composto. Il trattamento delle cellule HeLa con esso a 2,5 mM o 5 mM per un giorno non influisce sulla vitalità cellulare, mentre il trattamento con 10 mM per un giorno provoca una diminuzione del 25,0% della vitalità cellulare. Il trattamento delle cellule con 2,5, 5 o 10 mM per due giorni provoca una diminuzione della vitalità dell'11,5%, 38,0% e 79,4%, rispettivamente. Diminuisce la vitalità cellulare in modo tempo- e dose-dipendente e accorcia significativamente la durata dell'arresto prometasico indotto dal nocodazolo. La soppressione dell'Autophagy da parte della 3-MA inibisce la morte cellulare indotta da SU11274. Il trattamento prolungato con esso (fino a 9 ore) induce una significativa conversione di LC3 I a II nei MEF di tipo selvaggio. Il trattamento prolungato con 3-MA, ma non con wortmannina, aumenta marcatamente la punteggiatura/aggregazione di GFP-LC3. La sua conversione di LC3 indotta e la liberazione di GFP libera sono ATG7-dipendenti. Il trattamento con esso porta a un evidente aumento del livello della proteina p62. Il composto aumenta il livello di p62 anche nei MEF Atg5−/− così come nelle cellule con delezione di ATG5 mediata da DOX. Inibisce la PI3K di classe I e di classe III con schemi temporali diversi. La sua conversione di LC3 I a LC3 II indotta è drasticamente compromessa nelle cellule Tsc2−/− rispetto alle cellule di tipo selvaggio. Questo composto interrompe la funzione anti-autofagica del complesso mTOR 1. |
| Saggio chinasico |
Saggio di degradazione proteica
|
|
Le cellule HeLa vengono radiomarcate per 24 ore con 0,05 mCi/mL di l-[U- 14C]valina. Al termine del periodo di marcatura, le cellule vengono risciacquate tre volte con PBS. Le cellule vengono incubate per i tempi designati in terreno completo o EBSS con o senza la presenza di 10 mM di 3-Methyladenine (3-MA).
|
|
| In vivo |
La 3-Methyladenine (3-MA) blocca l'Autophagy attraverso il suo effetto sulla fosfatidilinositolo 3-chinasi (PI3K) di classe III. Il trattamento con questo composto non altera il grado di emorragia rispetto al gruppo con emorragia subaracnoidea (SAH). Il suo pretrattamento aggrava significativamente i sintomi neurologici se confrontato con il gruppo SAH + veicolo. L'Autophagy è diminuita quando viene applicata. Al contrario, la caspasi-3 clivata è marcatamente sovraregolata nel gruppo SAH + 3-MA. In linea con la sovraregolazione dell'espressione della caspasi-3 clivata, il numero di cellule TUNEL-positive nella corteccia destra è significativamente aumentato nel gruppo SAH + 3-MA rispetto al gruppo SAH + veicolo. |
Riferimenti |
|
Applicazioni
| Metodi | Biomarcatori | Immagini | PMID |
|---|---|---|---|
| Western blot | α-SMA / TGF-β / LC-3BI / LC-3B II / Beclin-1 / NF-κB p65 caspase-3 / caspase-9 / PARP VEGF APP / BACE1 / ADAM17 / Presenilin 1 / Presenilin 2 / Nicastrin / APH-1 / Pen-2 / LC3-1 / LC3-2 |
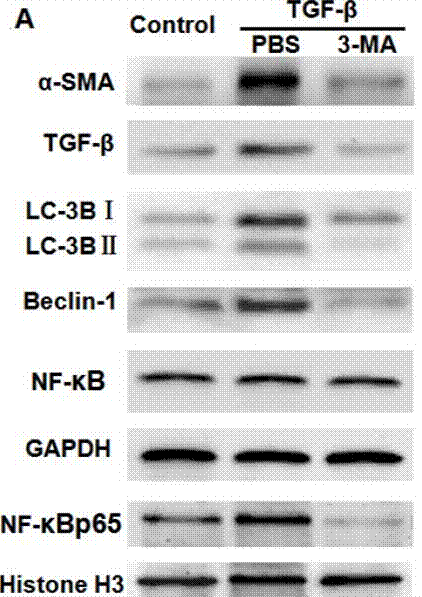
|
29296191 |
| Immunofluorescence | LC3 / Hif-α / COX2 |
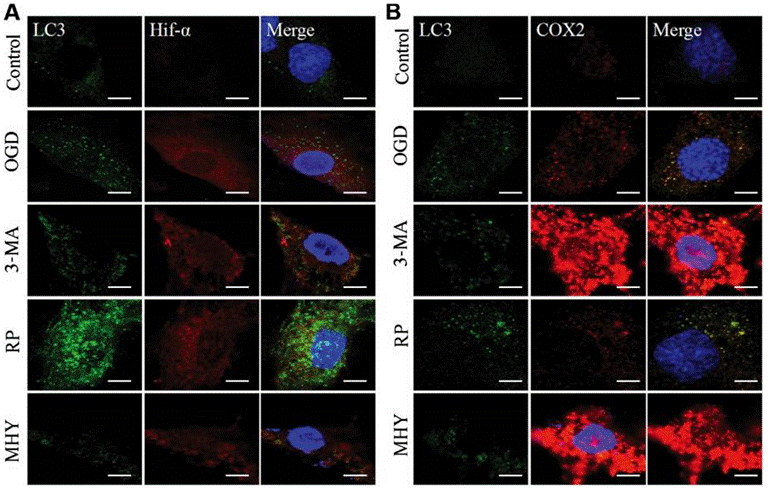
|
29039446 |
| Growth inhibition assay | Cell viability |
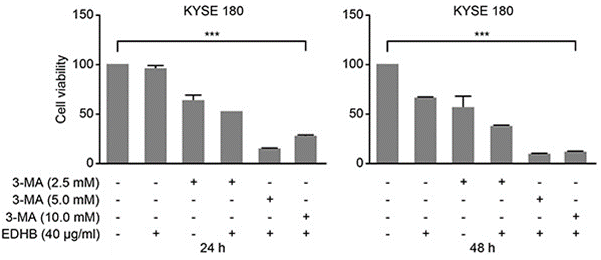
|
26934124 |
Supporto tecnico
Istruzioni per la manipolazione
Tel: +1-832-582-8158 Ext:3
Per qualsiasi altra domanda, si prega di lasciare un messaggio.
Domande Frequenti
Domanda 1:
I'm also wondering whether it can be dissolved in water, or maybe something like culture medium, normal saline solution to form 10mM solution.
Risposta:
As the reference (http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal. pone.0035665), it was found to inhibit autophagy at concentrations ranging from 1 to 10 mM and was directly dissolved into the culture medium at the indicated concentrations. And we tested the solubility of S2767, and found its solubility in DMEM is 31 mg/mL at about 40°C.
