solo per uso di ricerca
LDN-57444 DUB inibitore
N. Cat.S7135
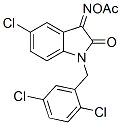
Struttura chimica
Peso molecolare: 397.64
Controllo Qualità
- Citato in Nature Medicine per la sua qualità superiore
- COA
- NMR
- SDS
- Scheda tecnica
| Target correlati | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease |
|---|---|
| Altro DUB Inibitori | PR-619 P5091 IU1 P22077 b-AP15 ML323 VLX1570 TCID EOAI3402143 ML364 |
Informazioni chimiche, conservazione e stabilità
| Peso molecolare | 397.64 | Formula | C17H11Cl3N2O3 |
Conservazione (Dalla data di ricezione) | |
|---|---|---|---|---|---|
| N. CAS | 668467-91-2 | Scarica SDF | Conservazione delle soluzioni stock |
|
|
| Sinonimi | N/A | Smiles | CC(=O)ON=C1C2=C(C=CC(=C2)Cl)N(C1=O)CC3=C(C=CC(=C3)Cl)Cl | ||
Solubilità
|
In vitro |
DMSO
: 11 mg/mL
(27.66 mM)
Water : Insoluble Ethanol : Insoluble |
Calcolatore di Molarità
|
In vivo |
|||||
Calcolatore di formulazione in vivo (Soluzione chiara)
Passo 1: Inserire le informazioni di seguito (Consigliato: Un animale aggiuntivo per tenere conto della perdita durante lesperimento)
Passo 2: Inserire la formulazione in vivo (Questo è solo il calcolatore, non la formulazione. Contattateci prima se non cè una formulazione in vivo nella sezione Solubilità.)
Risultati del calcolo:
Concentrazione di lavoro: mg/ml;
Metodo per preparare il liquido master di DMSO: mg farmaco predissolto in μL DMSO ( Concentrazione del liquido master mg/mL, Vi preghiamo di contattarci prima se la concentrazione supera la solubilità del DMSO del lotto del farmaco. )
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungereμL PEG300, mescolare e chiarire, quindi aggiungereμL Tween 80, mescolare e chiarire, quindi aggiungere μL ddH2O, mescolare e chiarire.
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungere μL Olio di mais, mescolare e chiarire.
Nota: 1. Si prega di assicurarsi che il liquido sia limpido prima di aggiungere il solvente successivo.
2. Assicurarsi di aggiungere il/i solvente/i in ordine. È necessario assicurarsi che la soluzione ottenuta, nellaggiunta precedente, sia una soluzione limpida prima di procedere allaggiunta del solvente successivo. Metodi fisici come il vortex, gli ultrasuoni o il bagno dacqua calda possono essere utilizzati per facilitare la dissoluzione.
Meccanismo dazione
| Targets/IC50/Ki |
UCH-L1
0.4 μM(Ki)
UCH-L1
0.88 μM
UCH-L3
25 μM
|
|---|---|
| In vitro |
Il trattamento con 50 μM di LDN-57444 per 24 ore porta a un'inibizione del 70% dell'attività del proteasoma. Questo composto provoca una diminuzione significativa e concentrazione-dipendente della vitalità cellulare a concentrazioni superiori a 25 μM e la vitalità cellulare si riduce al 61,81% a 50 μM. È in grado di causare la morte cellulare attraverso il percorso dell'apoptosi diminuendo l'attività del sistema ubiquitina proteasoma e aumentando i livelli di proteine altamente ubiquitinate, entrambi i quali possono attivare la risposta proteica non ripiegata. L'apoptosi indotta da questa sostanza chimica può essere innescata dall'attivazione dello stress del reticolo endoplasmatico (ERS).
|
| Saggio chinasico |
Screening HTS
|
|
Per iniziare un saggio, 0,5 μL di composto di prova da 5 mg/mL (circa 50 μM di concentrazione di reazione finale) o controllo DMSO vengono aliquote in ciascun pozzetto. Sia l'enzima che il substrato sono preparati in tampone di reazione UCH (50 mM Tris-HCl [pH 7,6], 0,5 mM EDTA, 5 mM DTT e 0,5 mg/mL di ovoalbumina). 25 μL di 0,6 nM UCH-L1 vengono quindi aggiunti a ciascun pozzetto eccetto i pozzetti di controllo del substrato, seguiti da agitazione della piastra per 45-60 s su uno shaker automatico. La miscela enzima/composto viene incubata a temperatura ambiente per 30 min prima di aggiungere 25 μL di 200 nM Ub-AMC per avviare la reazione enzimatica. La miscela di reazione (300 pM UCH-L1, 100 nM Ubiquitina-AMC con 2,5 μg di composto di prova) viene incubata a temperatura ambiente per altri 30 minuti prima di bloccare la reazione con l'aggiunta di 10 μL di acido acetico 500 mM per pozzetto. L'intensità di emissione della fluorescenza viene misurata su un LJL Analyst utilizzando un set di filtri alla cumarina (ex = 365 nm, em = 450 nm) e viene sottratta la fluorescenza intrinseca del composto per rivelare l'attività enzimatica. Un controllo DMSO (0,5 μL di DMSO, 25 μL di UCH-L1, 25 μL di ubiquitina-AMC, 10 μL di acido acetico), un controllo enzimatico (25 μL di UCH-L1, 25 μL di tampone, 10 μL di acido acetico), un controllo del substrato (25 μL di tampone, 25 μL di ubiquitina-AMC, 10 μL di acido acetico) e un controllo dell'inibitore (0,5 μL di aldeide di ubiquitina [stock 100 nM], 25 μL di UCH-L1, 25 μL di ubiquitina-AMC, 10 μL di acido acetico) vengono anche eseguiti in ciascuna piastra di saggio per garantire qualità e riproducibilità. I potenziali inibitori di UCH-L1 vengono selezionati se i composti hanno dimostrato un'inibizione superiore al 60% rispetto ai controlli. Le reazioni enzimatiche di UCH-L1 vengono ripetute manualmente due volte utilizzando lo stesso protocollo per confermare i risultati per i composti hit dallo screening primario assistito da robot.
|
|
| In vivo |
LDN-57444 provoca drammatiche alterazioni nella distribuzione delle proteine sinaptiche e nella morfologia delle spine in vivo. Il trattamento con questo composto comporta anche una rapida caduta dell'attività di Uch-L1, ma l'inibizione del proteasoma non ha alcun effetto sui livelli di cAMP per un periodo di diverse ore.
|
Riferimenti |
|
Supporto tecnico
Istruzioni per la manipolazione
Tel: +1-832-582-8158 Ext:3
Per qualsiasi altra domanda, si prega di lasciare un messaggio.
