solo per uso di ricerca
Pitavastatin (NK-104) Calcium HMG-CoA Reductase inibitore
N. Cat.S1759
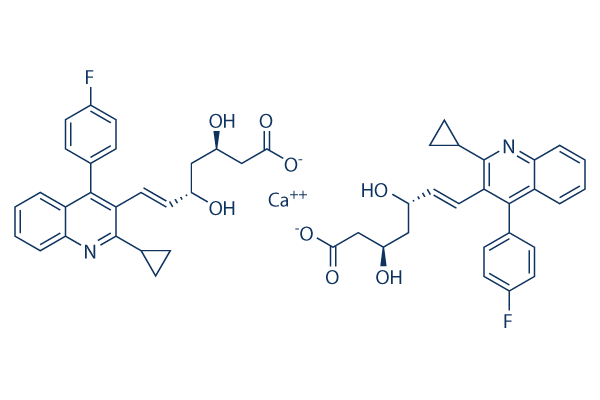
Struttura chimica
Peso molecolare: 880.98
Controllo Qualità
| Target correlati | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Altro HMG-CoA Reductase Inibitori | Mevastatin SR-12813 Clinofibrate Dihydrolanosterol 7-ketocholesterol Cerivastatin sodium |
Coltura cellulare, trattamento e concentrazione di lavoro
| Linee cellulari | Tipo di saggio | Concentrazione | Tempo di incubazione | Formulazione | Descrizione dellattività | PMID |
|---|---|---|---|---|---|---|
| HEK293 | Function assay | Drug uptake in HEK293 cells expressing OATP1B1 (unknown origin) assessed as OATP1B1-mediated drug transport, Km = 4.8 μM. | 22587986 | |||
| hepatocytes | Function assay | 0.1 to 10 uM | up to 90 mins | Drug metabolism in Sprague-Dawley rat hepatocytes assessed per 10'6 cells at 0.1 to 10 uM up to 90 mins by media-loss method, Km = 13 μM. | 22593038 | |
| Neuro2a | Function assay | 1 uM | Inhibition of delta 8-7 isomerase in mouse Neuro2a cells assessed as decrease in 7-DHC levels at 1 uM by LC-MS/GC-MS analysis | 26789657 | ||
| Neuro2a | Function assay | 1 uM | Inhibition of DR24 in mouse Neuro2a cells assessed as decrease in 7-DHC levels at 1 uM by LC-MS/GC-MS analysis | 26789657 | ||
| Neuro2a | Function assay | 1 uM | Inhibition of HMGCoA reductase in Dhcr7-deficient mouse Neuro2a cells assessed as decrease in 7-DHC levels at 1 uM by LC-MS/GC-MS analysis | 26789657 | ||
| MCF-7 | Function assay | 10 uM | 24 hrs | Antagonist activity at Myc-tagged RXRalpha (unknown origin) expressed in human MCF-7 cells assessed as inhibition of 9-cis-RA induced receptor transactivation at 10 uM after 24 hrs by luciferase reporter gene assay | 28089347 | |
| MCF-7 | Function assay | 1 uM | 24 hrs | Antagonist activity at Myc-tagged RXRalpha (unknown origin) expressed in human MCF-7 cells assessed as inhibition of 9-cis-RA induced receptor transactivation at 1 uM after 24 hrs by luciferase reporter gene assay | 28089347 | |
| Clicca per visualizzare più dati sperimentali sulle linee cellulari | ||||||
Informazioni chimiche, conservazione e stabilità
| Peso molecolare | 880.98 | Formula | C50H46CaF2N2O8 |
Conservazione (Dalla data di ricezione) | |
|---|---|---|---|---|---|
| N. CAS | 147526-32-7 | Scarica SDF | Conservazione delle soluzioni stock |
|
|
| Sinonimi | NK-104 calcium | Smiles | C1CC1C2=NC3=CC=CC=C3C(=C2C=CC(CC(CC(=O)[O-])O)O)C4=CC=C(C=C4)F.C1CC1C2=NC3=CC=CC=C3C(=C2C=CC(CC(CC(=O)[O-])O)O)C4=CC=C(C=C4)F.[Ca+2] | ||
Solubilità
|
In vitro |
DMSO
: 100 mg/mL
(113.5 mM)
Water : Insoluble Ethanol : Insoluble |
Calcolatore di Molarità
|
In vivo |
|||||
Calcolatore di formulazione in vivo (Soluzione chiara)
Passo 1: Inserire le informazioni di seguito (Consigliato: Un animale aggiuntivo per tenere conto della perdita durante lesperimento)
Passo 2: Inserire la formulazione in vivo (Questo è solo il calcolatore, non la formulazione. Contattateci prima se non cè una formulazione in vivo nella sezione Solubilità.)
Risultati del calcolo:
Concentrazione di lavoro: mg/ml;
Metodo per preparare il liquido master di DMSO: mg farmaco predissolto in μL DMSO ( Concentrazione del liquido master mg/mL, Vi preghiamo di contattarci prima se la concentrazione supera la solubilità del DMSO del lotto del farmaco. )
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungereμL PEG300, mescolare e chiarire, quindi aggiungereμL Tween 80, mescolare e chiarire, quindi aggiungere μL ddH2O, mescolare e chiarire.
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungere μL Olio di mais, mescolare e chiarire.
Nota: 1. Si prega di assicurarsi che il liquido sia limpido prima di aggiungere il solvente successivo.
2. Assicurarsi di aggiungere il/i solvente/i in ordine. È necessario assicurarsi che la soluzione ottenuta, nellaggiunta precedente, sia una soluzione limpida prima di procedere allaggiunta del solvente successivo. Metodi fisici come il vortex, gli ultrasuoni o il bagno dacqua calda possono essere utilizzati per facilitare la dissoluzione.
Meccanismo dazione
| Targets/IC50/Ki |
cholesterol esters
HMG-CoA reductase
|
|---|---|
| In vitro |
La pitavastatina riduce significativamente sia i livelli intracellulari che la sintesi degli esteri del colesterolo. La pitavastatina migliora l'espressione del recettore LDL in vitro, così come la quantità di legame del LDL al recettore LDL. La pitavastatina mostra anche una più potente induzione dell'espressione dell'mRNA del recettore LDL rispetto a simvastatina e atorvastatina. La pitavastatina ha molti effetti pleiotropici in vitro e in vivo, tra cui la prevenzione della progressione dell'aterosclerosi tramite l'inibizione della sintesi del trombossano, l'inibizione della migrazione/proliferazione delle cellule muscolari lisce vascolari indotta dall'angiotensina II e la stabilizzazione della placca aterosclerotica.
La pitavastatina è in grado di attivare il PPARα e indurre l'apoA-I del HDL attraverso l'induzione dell'inibizione della via di segnalazione Rho.
Il trattamento con pitavastatina (1 μM) per 48 ore è in grado di aumentare l'espressione della proteina morfogenetica ossea-2 BMP-2 (2,5 volte) e dell'osteocalcina (10 volte) mediante l'inibizione della Rho-associated kinase negli osteoblasti umani. La pitavastatina inibisce la crescita e la formazione di colonie di cellule di cancro al fegato Huh-7 e cellule SMMC7721. Induce l'arresto delle cellule di cancro al fegato nella fase G1. Si osserva una maggiore proporzione di cellule sub-G1 dopo il trattamento con pitavastatina. La pitavastatina promuove la scissione della caspasi-9 e della caspasi-3 nelle cellule di cancro al fegato. La pitavastatina potrebbe regolare il NF-κB e l'anti-infiammazione nelle cellule di carcinoma epatocellulare. La pitavastatina potrebbe indurre la morte cellulare autofagica nelle cellule di glioma e promuovere la sensibilità delle cellule alla radioterapia. Potrebbe anche inibire la proliferazione cellulare e indurre l'apoptosi cellulare nelle cellule di colangiocarcinoma.
|
| In vivo |
La pitavastatina diminuisce la crescita tumorale e migliora la sopravvivenza dei topi portatori di tumore. La pitavastatina esercita un effetto protettivo sulla cardiomiopatia dilatata probabilmente attraverso la regolazione negativa del RAS circolante e locale, seguita dall'inibizione della fosforilazione della PKCb2, e di conseguenza promuovendo la fosforilazione della PLB, nonché l'attività e le espressioni di SERCA2a e RyR2, per cui la funzione cardiaca viene preservata nello sviluppo della DCM.
|
Riferimenti |
|
Applicazioni
| Metodi | Biomarcatori | Immagini | PMID |
|---|---|---|---|
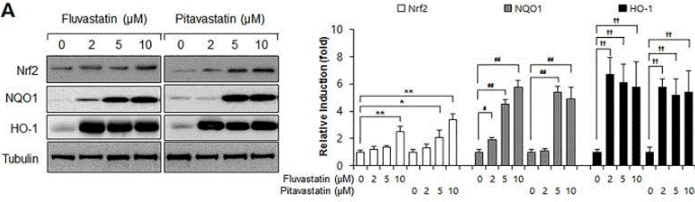
| Western blot | Nrf2 / NQO1 / HO-1 Flt1 / Flk1 VEGF / p-Akt / AKT / Jagged-1 / c-Notch1 / Notch-1 / Hes-1 |
|
28542559 |
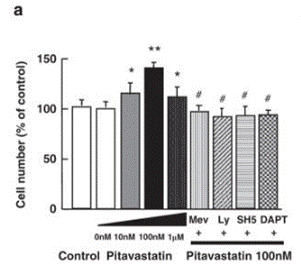
| Growth inhibition assay | Cell number |
|
21301413 |
Informazioni sullo studio clinico
(dati da https://clinicaltrials.gov, aggiornato il 2024-05-22)
| Numero NCT | Reclutamento | Condizioni | Sponsor/Collaboratori | Data di inizio | Fasi |
|---|---|---|---|---|---|
| NCT05977738 | Recruiting | Glioblastoma Multiforme Adult|Recurrent Glioblastoma |
C.Dirven|Erasmus Medical Center |
January 18 2024 | Early Phase 1 |
| NCT04643093 | Completed | Primary Hypercholesterolemia|Mixed Dyslipidemias |
Orient Pharma Co. Ltd. |
August 1 2020 | Phase 3 |
Supporto tecnico
Istruzioni per la manipolazione
Tel: +1-832-582-8158 Ext:3
Per qualsiasi altra domanda, si prega di lasciare un messaggio.
Domande Frequenti
Domanda 1:
How to prepare the solution of it for in vivo use?
Risposta:
You could use the formulation: 5% DMSO +40%PEG 300+5%Tween80+ddH2O for i.p., at a working concentration of 12.5mg/ml, stable for no longer than 40min.
