solo per uso di ricerca
Cholic acid
N. Cat.S3742
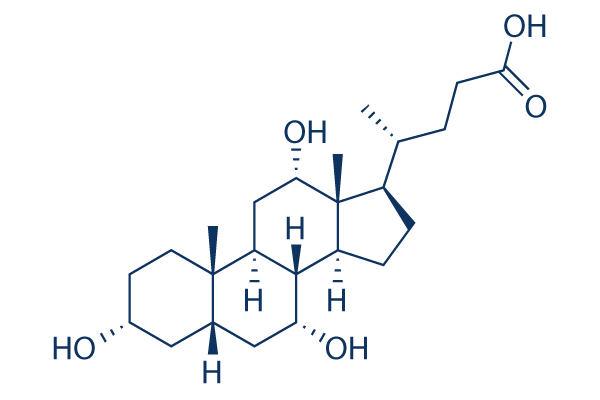
Struttura chimica
Peso molecolare: 408.57
Controllo Qualità
- Citato in Nature Medicine per la sua qualità superiore
- COA
- SDS
- Scheda tecnica
Informazioni chimiche, conservazione e stabilità
| Peso molecolare | 408.57 | Formula | C24H40O5 |
Conservazione (Dalla data di ricezione) | |
|---|---|---|---|---|---|
| N. CAS | 81-25-4 | Scarica SDF | Conservazione delle soluzioni stock |
|
|
| Sinonimi | N/A | Smiles | CC(CCC(=O)O)C1CCC2C1(C(CC3C2C(CC4C3(CCC(C4)O)C)O)O)C | ||
Solubilità
|
In vitro |
DMSO
: 81 mg/mL
(198.25 mM)
Ethanol : 28 mg/mL Water : Insoluble |
Calcolatore di Molarità
|
In vivo |
|||||
Calcolatore di formulazione in vivo (Soluzione chiara)
Passo 1: Inserire le informazioni di seguito (Consigliato: Un animale aggiuntivo per tenere conto della perdita durante lesperimento)
Passo 2: Inserire la formulazione in vivo (Questo è solo il calcolatore, non la formulazione. Contattateci prima se non cè una formulazione in vivo nella sezione Solubilità.)
Risultati del calcolo:
Concentrazione di lavoro: mg/ml;
Metodo per preparare il liquido master di DMSO: mg farmaco predissolto in μL DMSO ( Concentrazione del liquido master mg/mL, Vi preghiamo di contattarci prima se la concentrazione supera la solubilità del DMSO del lotto del farmaco. )
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungereμL PEG300, mescolare e chiarire, quindi aggiungereμL Tween 80, mescolare e chiarire, quindi aggiungere μL ddH2O, mescolare e chiarire.
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungere μL Olio di mais, mescolare e chiarire.
Nota: 1. Si prega di assicurarsi che il liquido sia limpido prima di aggiungere il solvente successivo.
2. Assicurarsi di aggiungere il/i solvente/i in ordine. È necessario assicurarsi che la soluzione ottenuta, nellaggiunta precedente, sia una soluzione limpida prima di procedere allaggiunta del solvente successivo. Metodi fisici come il vortex, gli ultrasuoni o il bagno dacqua calda possono essere utilizzati per facilitare la dissoluzione.
Meccanismo dazione
| In vitro |
La fosfomicina è nota per inibire MurA legandosi covalentemente a una cisteina altamente conservata nel sito attivo dell'enzima. La fosfomicina è un mimetico del PEP che agisce alchilando la Cys115 altamente conservata (numerazione di Escherichia coli) di MurA. La fosfomicina esercita effetti immunomodulatori alterando la funzione dei linfociti, monociti e neutrofili. Influisce sulla risposta acuta delle citochine infiammatorie in vitro e in vivo. Sopprime la produzione del fattore di necrosi tumorale alfa (TNF-α), dell'interleuchina-1β (IL-1β) e dell'IL-1α e aumenta la produzione di IL-10. La fosfomicina sopprime la produzione di IL-2 dalle cellule T, la produzione di leucotriene B4 (LTB4) dai neutrofili e l'espressione dell'mRNA di IL-8 da parte del LTB4 dai monociti. La fosfomicina mostra anche un effetto immunomodulatore sull'attivazione delle cellule B. La fosfomicina migliora l'uccisione fagocitica dei patogeni invasori da parte dei neutrofili, anche nei pazienti sottoposti a emodialisi cronica e trapianto renale. La fosfomicina ha dimostrato una maggiore capacità battericida dei neutrofili rispetto ad altri antimicrobici. La fosfomicina ha la capacità di penetrare nei biofilm. La fosfomicina è considerevolmente attiva contro i patogeni Gram-negativi e Gram-positivi.
|
|---|---|
| In vivo |
La biodisponibilità orale della fosfomicina trometamolo varia tra il 34 e il 58%. L'assorbimento avviene nell'intestino tenue e le prove suggeriscono che la co-somministrazione di fosfomicina trometamolo con il cibo può ridurre l'assorbimento del farmaco. L'emivita di eliminazione sierica media (t1/2) della fosfomicina trometamolo è stimata in 5,7 ore. La fosfomicina viene escreta non metabolizzata nelle urine, attraverso la filtrazione glomerulare. A seconda dell'età, del digiuno e della funzione renale, dall'11 al 60% del farmaco può essere trovato nelle urine entro 24 ore dalla somministrazione. Nello specifico, l'età avanzata, la somministrazione con un pasto e il deterioramento della funzione renale comportano un'eliminazione più lenta attraverso i reni. La fosfomicina attraversa la barriera emato-encefalica e l'infiammazione meningea ne aumenta la concentrazione nel liquor. La fosfomicina penetra anche nell'osso corticale e spugnoso, e la penetrazione correla con i livelli plasmatici e la presenza di infiammazione.
|
Riferimenti |
|
Informazioni sullo studio clinico
(dati da https://clinicaltrials.gov, aggiornato il 2024-05-22)
| Numero NCT | Reclutamento | Condizioni | Sponsor/Collaboratori | Data di inizio | Fasi |
|---|---|---|---|---|---|
| NCT02654496 | Completed | Obesity |
North Dakota State University |
January 2016 | -- |
| NCT01865812 | Completed | Primary Biliary Cirrhosis |
Intercept Pharmaceuticals |
December 3 2013 | Phase 2 |
| NCT00596427 | Completed | Diabetes |
Carine Beysen|KineMed |
November 2007 | Not Applicable |
| NCT01589523 | Completed | Bile Acid Synthesis Defect|Inborn Error of Bile Acid Metabolism|Inborn Error of Bile Acid Conjugation |
Children''s Hospital Medical Center Cincinnati |
February 2006 | Phase 3 |
Supporto tecnico
Istruzioni per la manipolazione
Tel: +1-832-582-8158 Ext:3
Per qualsiasi altra domanda, si prega di lasciare un messaggio.
