solo per uso di ricerca
Benznidazole Parasite inibitore
N. Cat.S3741
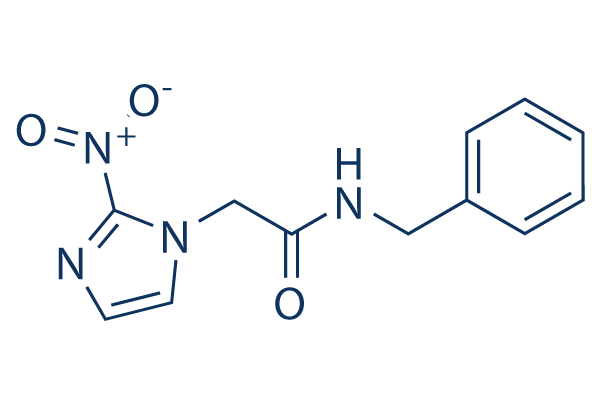
Struttura chimica
Peso molecolare: 260.25
Controllo Qualità
| Target correlati | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Reverse Transcriptase HIV HCV Protease |
|---|---|
| Altro Parasite Inibitori | Diminazene Aceturate Oxibendazole Avermectin B1 Oxfendazole Diclazuril Arteether Milbemycin Oxime (+/-)-nerolidol Selamectin Emodepside |
Informazioni chimiche, conservazione e stabilità
| Peso molecolare | 260.25 | Formula | C12H12N4O3 |
Conservazione (Dalla data di ricezione) | |
|---|---|---|---|---|---|
| N. CAS | 22994-85-0 | Scarica SDF | Conservazione delle soluzioni stock |
|
|
| Sinonimi | Radanil | Smiles | C1=CC=C(C=C1)CNC(=O)CN2C=CN=C2[N+](=O)[O-] | ||
Solubilità
|
In vitro |
DMSO
: 52 mg/mL
(199.8 mM)
Ethanol : 5 mg/mL Water : Insoluble |
Calcolatore di Molarità
|
In vivo |
|||||
Calcolatore di formulazione in vivo (Soluzione chiara)
Passo 1: Inserire le informazioni di seguito (Consigliato: Un animale aggiuntivo per tenere conto della perdita durante lesperimento)
Passo 2: Inserire la formulazione in vivo (Questo è solo il calcolatore, non la formulazione. Contattateci prima se non cè una formulazione in vivo nella sezione Solubilità.)
Risultati del calcolo:
Concentrazione di lavoro: mg/ml;
Metodo per preparare il liquido master di DMSO: mg farmaco predissolto in μL DMSO ( Concentrazione del liquido master mg/mL, Vi preghiamo di contattarci prima se la concentrazione supera la solubilità del DMSO del lotto del farmaco. )
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungereμL PEG300, mescolare e chiarire, quindi aggiungereμL Tween 80, mescolare e chiarire, quindi aggiungere μL ddH2O, mescolare e chiarire.
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungere μL Olio di mais, mescolare e chiarire.
Nota: 1. Si prega di assicurarsi che il liquido sia limpido prima di aggiungere il solvente successivo.
2. Assicurarsi di aggiungere il/i solvente/i in ordine. È necessario assicurarsi che la soluzione ottenuta, nellaggiunta precedente, sia una soluzione limpida prima di procedere allaggiunta del solvente successivo. Metodi fisici come il vortex, gli ultrasuoni o il bagno dacqua calda possono essere utilizzati per facilitare la dissoluzione.
Meccanismo dazione
| In vitro |
Benznidazole (BZL) inibisce la proliferazione delle cellule leucemiche non aderenti controllando il ciclo cellulare nella fase G0/G1 attraverso l'up-regulation di p27. L'inibizione della crescita indotta da questo composto è un processo reversibile, non accompagnato da una significativa morte cellulare. Oltre alla sua attività tripanocida, ha anche un effetto immunomodulatore sui macrofagi bloccando la trascrizione di alcuni mediatori pro-infiammatori senza alterare l'espressione dell'interleuchina 10.
|
|---|---|
| In vivo |
Nei topi, la somministrazione orale di Benznidazole (100 mg/kg): il tempo per raggiungere la concentrazione massima (Tmax) nel plasma era di 0,83 h, e la concentrazione massima (Cmax) nel plasma era di 41,61 μg/ml. L'emivita di eliminazione (t1/2b) di questo composto era di 2,03 h e il tempo medio di residenza (MRT) era di 3,86 h. Il volume di distribuzione (V) e la clearance (CL), entrambi in funzione della sua biodisponibilità (F), erano rispettivamente di 38,81 ml e 13,29 ml/h. Nei ratti Wistar trattati per via orale, i Tmax di questa sostanza chimica sono rispettivamente di 2,0 e 1,1 h. Tmax di 15, 30 o 60 min, a seconda della dose, in topi BALB/c dopo trattamento intraperitoneale e Tmax da 1 a 5 h per cani trattati per via orale. Può attraversare la barriera emato-encefalica ed esercitare la sua azione in caso di Parasite del sistema nervoso centrale. Tuttavia, altri studi hanno indicato che questo composto ha effetti tossici sul sistema nervoso centrale. Cani trattati per via orale con esso hanno presentato encefalopatia con caratteristiche multifocali e disturbi clinici, patologici e neurologici che erano dose-dipendenti e tempo-dipendenti. La sua biodistribuzione avviene ampiamente, raggiungendo il cuore e il colon, che sono gli organi più rilevanti per l'infezione da T. cruzi, e anche la milza, il cervello, il fegato, i polmoni e i reni.
|
Riferimenti |
|
Informazioni sullo studio clinico
(dati da https://clinicaltrials.gov, aggiornato il 2024-05-22)
| Numero NCT | Reclutamento | Condizioni | Sponsor/Collaboratori | Data di inizio | Fasi |
|---|---|---|---|---|---|
| NCT03892213 | Completed | Chagas Disease |
Drugs for Neglected Diseases|PhinC Development |
October 2014 | Phase 1 |
| NCT01755403 | Completed | Chagas Disease |
Barcelona Centre for International Health Research |
December 2012 | Phase 4 |
| NCT01547533 | Completed | Chagas Disease|Lactation |
Hospital de Niños R. Gutierrez de Buenos Aires |
August 2011 | -- |
| NCT01489228 | Unknown status | Chronic Chagas Disease Indeterminate |
Drugs for Neglected Diseases|Eisai Co. Ltd. |
June 2011 | Phase 2 |
| NCT00699387 | Completed | Chagas Disease |
Hospital de Niños R. Gutierrez de Buenos Aires|Thrasher Research Fund|The Hospital for Sick Children|Fundacion Bunge y Born (Argentina)|Universidad Nacional de La Plata|Consejo de Investigacion en Salud Gobierno de Buenos Aires |
April 2007 | Not Applicable |
Supporto tecnico
Istruzioni per la manipolazione
Tel: +1-832-582-8158 Ext:3
Per qualsiasi altra domanda, si prega di lasciare un messaggio.
