solo per uso di ricerca
PNU-120596 AChR modulatore
N. Cat.S2629
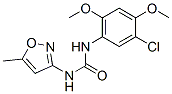
Struttura chimica
Peso molecolare: 311.72
Controllo Qualità
Informazioni chimiche, conservazione e stabilità
| Peso molecolare | 311.72 | Formula | C13H14ClN3O4 |
Conservazione (Dalla data di ricezione) | |
|---|---|---|---|---|---|
| N. CAS | 501925-31-1 | Scarica SDF | Conservazione delle soluzioni stock |
|
|
| Sinonimi | Nsc 216666 | Smiles | CC1=CC(=NO1)NC(=O)NC2=CC(=C(C=C2OC)OC)Cl | ||
Solubilità
|
In vitro |
DMSO
: 62 mg/mL
(198.89 mM)
Ethanol : 1 mg/mL Water : Insoluble |
Calcolatore di Molarità
|
In vivo |
|||||
Calcolatore di formulazione in vivo (Soluzione chiara)
Passo 1: Inserire le informazioni di seguito (Consigliato: Un animale aggiuntivo per tenere conto della perdita durante lesperimento)
Passo 2: Inserire la formulazione in vivo (Questo è solo il calcolatore, non la formulazione. Contattateci prima se non cè una formulazione in vivo nella sezione Solubilità.)
Risultati del calcolo:
Concentrazione di lavoro: mg/ml;
Metodo per preparare il liquido master di DMSO: mg farmaco predissolto in μL DMSO ( Concentrazione del liquido master mg/mL, Vi preghiamo di contattarci prima se la concentrazione supera la solubilità del DMSO del lotto del farmaco. )
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungereμL PEG300, mescolare e chiarire, quindi aggiungereμL Tween 80, mescolare e chiarire, quindi aggiungere μL ddH2O, mescolare e chiarire.
Metodo per preparare la formulazione in vivo: Prendere μL DMSO liquido master, quindi aggiungere μL Olio di mais, mescolare e chiarire.
Nota: 1. Si prega di assicurarsi che il liquido sia limpido prima di aggiungere il solvente successivo.
2. Assicurarsi di aggiungere il/i solvente/i in ordine. È necessario assicurarsi che la soluzione ottenuta, nellaggiunta precedente, sia una soluzione limpida prima di procedere allaggiunta del solvente successivo. Metodi fisici come il vortex, gli ultrasuoni o il bagno dacqua calda possono essere utilizzati per facilitare la dissoluzione.
Meccanismo dazione
| Targets/IC50/Ki |
α7 nAChR
216 nM(EC50)
|
|---|---|
| In vitro |
PNU-120596 aumenta il flusso di calcio evocato dall'agonista (Ach) mediato da una variante ingegnerizzata del recettore α7 nAChR umano. Questo composto aumenta le correnti evocate dagli agonisti (colina e ACh) mediate dai recettori wild-type e dimostra anche un prolungamento pronunciato della risposta evocata in presenza continua dell'agonista in ovociti di Xenopus. Aumenta il tempo medio di apertura del canale dei recettori α7 nAChRs ma non ha alcun effetto sulla selettività ionica e relativamente poco, se del caso, effetto sulla conduttanza unitaria. Quando applicato a fette ippocampali acute, questa sostanza chimica aumenta la frequenza delle correnti postsinaptiche GABAergiche evocate da ACh misurate nei neuroni piramidali; questo effetto è soppresso da TTX, suggerendo che modula la funzione dei recettori α7 nAChRs localizzati sulla membrana somatodendritica degli interneuroni ippocampali. Oltre alla modulazione positiva del recettore α7 nAChR, questo composto induce un profondo ritardo della cinetica di desensibilizzazione, aumentando il potenziale di tossicità indotta da Ca2+ attraverso un'eccessiva stimolazione del recettore α7 nAChR. Provoca cambiamenti nell'accessibilità della cisteina al foglietto beta interno, alla zona di transizione e al sito di legame dell'agonista durante il legame al recettore α7 nAChR. I siti di legame per questa sostanza chimica non sono nei siti di legame dell'agonista e migliora l'apertura evocata dall'agonista dei recettori nicotinici elicitando effetti conformazionali che sono simili ma non identici alle conformazioni di apertura promosse da Ach.
|
| Saggio chinasico |
Saggio di fluorescenza Ca2+
|
|
Le cellule epiteliali umane SH-EP1 che esprimono una variante del α7 nAChR (α7*) vengono coltivate in un terreno essenziale minimo (MEM) contenente amminoacidi non essenziali supplementato con il 10% di siero bovino fetale, L-glutammina, 100 U/ml di penicillina/streptomicina, 250 ng/mL di fungizone, 400 μg/mL di igromicina B e 800 μg/mL di geneticina. α7* è una variante del α7 nAChR umano, con due mutazioni puntiformi nel primo dominio transmembrana (T230P e C241S) che consentono un'elevata espressione funzionale nelle cellule SH-EP1 [Groppi VE, Wolfe ML, Berkenpas MB (2003) U.S. Patent 6,693,172 B1]. Le cellule vengono coltivate in un incubatore a 37 °C con 6% di CO2. Le cellule vengono tripsinizzate e piastrate in piastre a 96 pozzetti con pareti laterali scure e fondi trasparenti a una densità di 2 × 104 cellule/pozzetto 2 giorni prima dell'analisi. Le cellule vengono caricate con una miscela di Calcium Green-1 AM in dimetilsolfossido anidro e 20% di pluronic F-127. Questo reagente viene aggiunto direttamente al terreno di crescita di ciascun pozzetto per ottenere una concentrazione finale di 2 μM di Calcium Green-1 AM. Le cellule vengono quindi incubate nel colorante per 1 ora a 37 °C e quindi lavate quattro volte con la soluzione salina bilanciata di Earle modificata da Mark (MMEBSS) composta come segue (in mM): 4 CaCl2, 0,8 MgSO4, 20 NaCl, 5,3 KCl, 5,6 D-glucosio, 20 Tris-HEPES e 120 N-metil-D-glucamina, pH 7,4. Dopo il quarto ciclo, le cellule vengono lasciate incubare a 37 °C per almeno 10 minuti. Il volume finale di MMEBSS in ciascun pozzetto è di 100 μL e l'atropina viene aggiunta a tutti i pozzetti per una concentrazione finale di 1 μM. Un lettore di piastre per imaging fluorimetrico (FLIPR; Molecular Devices, Union City, CA) è impostato per eccitare il Calcium Green a 488 nm utilizzando 500 mW di potenza e leggendo l'emissione di fluorescenza >525 nm. Viene utilizzata un'esposizione di 0,5 secondi per illuminare ciascun pozzetto. La fluorescenza viene rilevata utilizzando un set F-stop di 2,0 o 1,2. Dopo 30 secondi di registrazione di base, i composti di prova vengono aggiunti a ciascun pozzetto di una piastra a 96 pozzetti in 50 μL di uno stock 3 ×. In ogni esperimento, quattro pozzetti vengono utilizzati come controlli del veicolo (0,2% DMSO).
|
|
| In vivo |
La somministrazione sistemica di PNU-120596 (1 mg/kg) a ratti migliora il deficit di gating uditivo causato dall'amfetamina, un modello proposto per riflettere una perturbazione a livello di circuito associata alla schizofrenia. Quando somministrato prima della Carragenina, 30 mg/kg di questo composto attenuano significativamente l'iperalgesia meccanica e i deficit di carico ponderale per un massimo di 4 ore. Questa sostanza chimica attenua l'aumento indotto dalla carraghenina dei livelli di TNF-α e IL-6 all'interno dell'edema della zampa posteriore, mentre il diclofenac attenua solo i livelli di IL-6. L'iperalgesia meccanica stabilita indotta dalla Carragenina o dalla CFA è anche parzialmente invertita da questo agente.
|
Riferimenti |
|
Supporto tecnico
Istruzioni per la manipolazione
Tel: +1-832-582-8158 Ext:3
Per qualsiasi altra domanda, si prega di lasciare un messaggio.
