solo per uso di ricerca
Anti-DYKDDDDK Tag magnetic beads
Le microsfere magnetiche Anti-DYKDDDDK Tag sono basate su microsfere magnetiche idrossilate accoppiate covalentemente con anticorpi monoclonali di topo ricombinanti di alta qualità. Con un alto carico di proteina DYKDDDDK-tagged (più di 0,6 mg di proteina/mL) e alta specificità, è raccomandato luso per la co-immunoprecipitazione e la purificazione delle proteine.
Sellecks È stato citato da 119 Pubblicazioni
Vantaggi
Risparmio di tempo: risparmia 15-30 min rispetto alle microsfere di agarosio.
Funzionamento semplice: separazione magnetica e senza centrifugazione.
Elevata capacità di caricamento proteico.
Elevata specificità.
Confronto Prodotto
Descrizione
Le microsfere magnetiche Anti-DYKDDDDK Tag sono basate su microsfere magnetiche idrossilate accoppiate covalentemente con anticorpi monoclonali di topo ricombinanti di alta qualità. Con un alto carico di proteina DYKDDDDK-tagged (più di 0,6 mg di proteina/mL) e alta specificità, è raccomandato luso per la co-immunoprecipitazione e la purificazione delle proteine.
Proprietà
| Isotipo dellanticorpo | Anticorpo monoclonale di topo ricombinante |
|---|---|
| Purificazione dellanticorpo | Purificato con Proteina A |
| Applicazione | Immunoprecipitazione e purificazione delle proteine |
| Volume raccomandato | IP: 20 μl di microsfere per 200 μl di soluzione proteica grezza |
| Capacità di legame | Minimo 0,6 mg di proteina eluita per ml di microsfere magnetiche |
| Caratteristiche di legame | Proteina di fusione Met-N-terminale DYKDDDDK Tag: Met-DYKDDDDK Tag–Proteina Proteina di fusione N-terminale DYKDDDDK Tag: DYKDDDDK Tag–Proteina Proteina di fusione C-terminale DYKDDDDK Tag: Proteina-DYKDDDDK Tag |
Conservazione (dalla data di ricezione)
Conservare a 2-8°C per 2 anni.
Protocollo
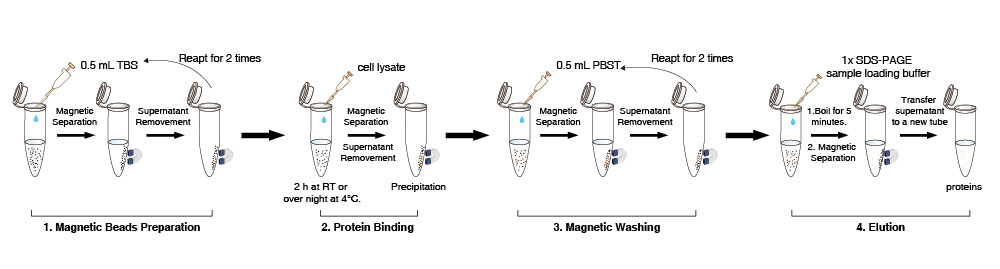
Preparazione delle microsfere magnetiche
1. Sospendere le microsfere magnetiche Anti-DYKDDDDK Tag nel flacone (pipettare delicatamente per 10 volte, non vortexare). Trasferire 10 µL (la quantità può essere aumentata o diminuita secondo necessità) di sospensione di microsfere magnetiche Anti-DYKDDDDK Tag in una nuova provetta.
2. Aggiungere 0,5 mL di tampone TBS (50 mM Tris HCl, 150 mM NaCl, pH 7,4). Pipettare delicatamente per 5 volte le microsfere magnetiche Anti-DYKDDDDK Tag. Posizionare la provetta sul magnete per separare le microsfere dalla soluzione per 1-2 min (può essere opportunamente esteso a 5 minuti) e rimuovere il surnatante. Ripetere questo passaggio per 2 volte.
Nota: Preparare tutte le microsfere magnetiche insieme in un tubo grande e poi dividerle in aliquote se i campioni sono in batch. Durante la rimozione del surnatante, aspirare delicatamente, poiché uneccessiva aspirazione può causare la perdita di alcune microsfere magnetiche.
Legame proteico
3. Aggiungere 500 µL di lisato cellulare alle microsfere magnetiche lavate. Ruotare delicatamente la provetta per 2 ore a temperatura ambiente o per tutta la notte a 4°C.
4. Posizionare la provetta sul magnete per separare le microsfere dalla soluzione per 1-2 min (può essere opportunamente esteso) e quindi trasferire il surnatante in una nuova provetta per rilevare se la proteina DYKDDDDK-tag è residua.
Nota: Durante il processo di legame, non influirà sul risultato se le microsfere magnetiche si raggruppano occasionalmente.
Lavaggio magnetico
5. Aggiungere 500 µL di PBST alla provetta (NaCl 136,89 mM; KCl 2,67 mM; Na2HPO4 8,1 mM; KH2PO4 1,76 mM; 0,5% Tween20), risospendere le microsfere magnetiche pipettando delicatamente. Quindi ruotare la provetta per 5 min. Posizionare la provetta sul magnete per separare le microsfere dalla soluzione per 10 sec e rimuovere il surnatante.
6. Ripetere il passaggio 5 per circa 2 volte. Se rimangono proteine di impurità non specifiche, prolungare il tempo di pulizia, aumentare i tempi di pulizia o aumentare correttamente il contenuto di detergente nella soluzione di pulizia.
Eluizione e rilevazione
Scegliere diversi metodi di eluizione in base alluso a valle. Per lIP, andare al passaggio 7-8. Per la purificazione delle proteine, andare al passaggio 9-10 per leluizione a basso pH.
Eluizione denaturante (adatta per esperimenti di IP utilizzando microsfere Anti-DYKDDDDK Tag):
7. Per la rilevazione diretta delle proteine target, aggiungere 50 µL di tampone di caricamento del campione 1×proteina nella precipitazione sopra menzionata, bollire per 5 min, raffreddare a temperatura ambiente e quindi posizionare la provetta sul magnete per separare le microsfere dalla soluzione per 1-2 min (può essere opportunamente esteso).
8. Rilevare il surnatante mediante SDS-PAGE.
Eluizione competitiva del polipeptide poli DYKDDDDK Tag (adatta per purificazioni proteiche con microsfere Anti-DYKDDDDK Tag):
9. Aggiungere il tampone TBS con 200 µg-1 mg/mL di peptide poli DYKDDDDK Tag (B23111) al prodotto del passaggio 6, e quindi incubarli su agitatore (4°C) per 2 h. Generalmente, il volume del peptide poli DYKDDDDK Tag è 5 volte quello del gel.
10. Posizionare i prodotti del passaggio precedente sulla separazione magnetica per la separazione magnetica. Trasferire il surnatante contenente la proteina target in una nuova provetta EP. Se è necessario riutilizzare le microsfere magnetiche, pulire il gel con 0,1 M glicina HCl (pH 3,0) ed effettuare il riciclo.
Eluizione a basso pH (adatta per la purificazione delle proteine con microsfere Anti-DYKDDDDK Tag):
11. Aggiungere il tampone di eluizione 0,1 M glicina HCl (pH 3,0) al prodotto del passaggio 6, e incubare su agitatore per 5 min (Il tempo di eluizione dovrebbe essere inferiore a 20 min). Generalmente, il volume del tampone di eluizione è 5 volte quello del gel.
12. Centrifugare i prodotti ottenuti dal passaggio precedente a 5000 rpm per 30 sec. Quindi trasferire rapidamente il prodotto di eluizione in 1 M Tris (pH 8,0) per la neutralizzazione fino a quando il pH è quasi neutro.
Risoluzione dei problemi
| Problema | Possibile causa | Miglioramento suggerito |
|---|---|---|
| Sfondo elevato | Legame non specifico delle proteine allanticorpo, alle microsfere magnetiche o alle provette EP | Pre-chiarire il lisato per rimuovere le proteine a legame non specifico. Dopo aver sospeso le microsfere per il lavaggio finale, trasferire lintero campione in una provetta EP pulita e quindi separare magneticamente. |
| I tempi di lavaggio non sono sufficienti. | Aumentare il numero di lavaggi. Aumentare la durata dei lavaggi. |
|
| Nessun segnale osservato. | La proteina DYKDDDDK-tag non è espressa nel campione. | Assicurarsi che la proteina di interesse contenga la sequenza DYKDDDDK Tag. Preparare il lisato fresco. Utilizzare inibitori delle proteasi appropriati. |
| I tempi di incubazione sono inadeguati. | Aumentare i tempi di incubazione. | |
| Sostanza interferente presente nel campione. | Il lisato può contenere alte concentrazioni di ditiotreitolo (DTT), 2-mercaptoetanolo o altri agenti riducenti. Uneccessiva concentrazione di detergente può interferire con linterazione anticorpo-antigene. |
Download del file
Altri prodotti correlati
Supporto tecnico
Se avete altre richieste, lasciate un messaggio.
