réservé à la recherche
Valganciclovir HCl CMV inhibiteur
N° Cat.S4050
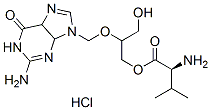
Structure chimique
Poids moléculaire: 390.82
Contrôle qualité
| Cibles apparentées | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite Reverse Transcriptase HIV |
|---|---|
| Autre CMV Inhibiteurs | Valaciclovir HCl Bisindolylmaleimide IV Brivudine (BVDU) |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 390.82 | Formule | C14H22N6O5.HCl |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 175865-59-5 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC(C)C(C(=O)OCC(CO)OCN1C=NC2=C1N=C(NC2=O)N)N.Cl | ||
Solubilité
|
In vitro |
DMSO
: 78 mg/mL
(199.58 mM)
Water : 78 mg/mL Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| In vitro |
Le chlorhydrate de Valganciclovir est un sel chlorhydrate de l'ester L-valyl du ganciclovir qui existe sous forme de mélange de deux diastéréoisomères. Après administration, ces diastéréoisomères sont rapidement convertis en ganciclovir par les estérases hépatiques et intestinales. Dans les cellules infectées par le cytomégalovirus (CMV), le ganciclovir est initialement phosphorylé en forme monophosphate par la protéine kinase virale, puis il est ensuite phosphorylé via des kinases cellulaires pour produire la forme triphosphate. Cette forme triphosphate est lentement métabolisée intracellulairement. La phosphorylation dépend de la kinase virale et se produit préférentiellement dans les cellules infectées par le virus. L'activité virustatique du ganciclovir est due à l'inhibition de la synthèse de l'ADN viral par le ganciclovir triphosphate. Le ganciclovir triphosphate est incorporé dans le brin d'ADN, remplaçant de nombreuses bases adénosine. Cela entraîne la prévention de la synthèse de l'ADN, car les ponts phosphodiester ne peuvent plus être construits, déstabilisant le brin. Le ganciclovir inhibe les ADN polymérases virales plus efficacement que la polymérase cellulaire, et l'élongation de la chaîne reprend lorsque le ganciclovir est retiré.
|
|---|---|
| In vivo |
Après administration orale, les estérases intestinales et hépatiques hydrolysent les deux diastéréoisomères en ganciclovir, qui inhibe la réplication du cytomégalovirus humain. Le Valganciclovir est bien absorbé par le tractus gastro-intestinal et la biodisponibilité absolue des comprimés de Valganciclovir (après administration avec de la nourriture) est d'environ 60 %.
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06407232 | Not yet recruiting | Cytomegalovirus Infections|Kidney Transplant Infection|Pancreas Transplant |
University of Wisconsin Madison|Merck Sharp & Dohme LLC |
May 2024 | Phase 3 |
| NCT06034925 | Recruiting | Transplant Complication|CMV |
Medical University of South Carolina|Takeda |
November 6 2023 | Phase 4 |
| NCT03301415 | Terminated | Congenital Cytomegalovirus Infection |
National Institute of Allergy and Infectious Diseases (NIAID) |
August 21 2019 | Phase 2 |
| NCT03698435 | Unknown status | Cytomegalovirus Infections |
University Medical Center Groningen |
May 25 2018 | -- |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
