uitsluitend voor onderzoeksdoeleinden
BGJ398 (Infigratinib) FGFR remmer
Cat.Nr.S2183
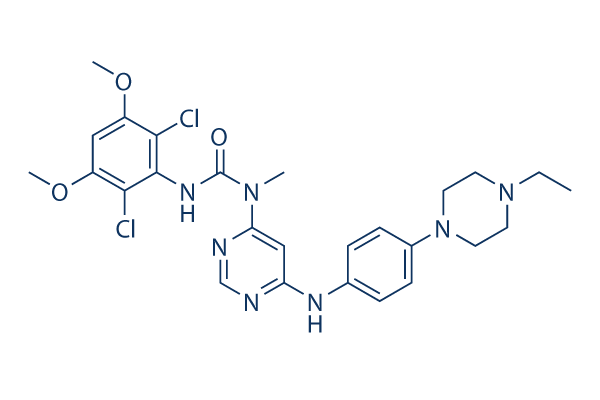
Chemische structuur
Moleculair gewicht: 560.48
Kwaliteitscontrole
Producten Vaak Samen Gebruikt Met BGJ398 (Infigratinib)
| Gerelateerde doelwitten | EGFR VEGFR JAK PDGFR Src HIF FLT FLT3 HER2 Bcr-Abl |
|---|---|
| Overige FGFR Inhibitoren | PD173074 AZD4547 (Fexagratinib) BLU9931 Futibatinib (TAS-120) LY2874455 PD-166866 Zoligratinib (Debio-1347) H3B-6527 Fisogatinib (BLU-554) SSR128129E |
Celkweek, behandeling & werkconcentratie
| Cellijnen | Assaytype | Concentratie | Incubatietijd | Formulering | Activiteitsbeschrijving | PMID |
|---|---|---|---|---|---|---|
| HCC | Growth Inhibition Assay | 1-2500 nM | 48 h | IC50= 2359 nm | 25688743 | |
| HCC | Growth Inhibition Assay | 1-2500 nM | 48 h | IC50=1124 nm | 25688743 | |
| HCT116 | Growth Inhibition Assay | 48 h | IC50=3 μM | 24503538 | ||
| HKH2 | Growth Inhibition Assay | 48 h | IC50=4 μM | 24503538 | ||
| RKO | Growth Inhibition Assay | 48 h | IC50=1.2 μM | 24503538 | ||
| LS174T | Growth Inhibition Assay | 48 h | IC50=4 μM | 24503538 | ||
| HCD9 | Growth Inhibition Assay | 0.5-5 μM | 48/72 h | DMSO | decreases cell viability | 24135816 |
| HCT116 | Growth Inhibition Assay | 0.5-5 μM | 48/72 h | DMSO | decreases cell viability | 24135816 |
| SNU-C1 | Growth Inhibition Assay | 0.5-5 μM | 48/72 h | DMSO | no effect | 24135816 |
| MFE280 | Growth Inhibition Assay | IC50=2.63 ± 0.82 μM | 23443805 | |||
| AN3CA | Growth Inhibition Assay | IC50=1.00 ± 0.20 μM | 23443805 | |||
| HEC155 | Growth Inhibition Assay | IC50=4.74 ± 1.09 μM | 23443805 | |||
| MFE296 | Growth Inhibition Assay | IC50=2.86 ± 0.20 μM | 23443805 | |||
| SPAC1S | Growth Inhibition Assay | IC50=3.19 ± 0.93 μM | 23443805 | |||
| RL952 | Growth Inhibition Assay | IC50=3.41 ± 0.23 μM | 23443805 | |||
| EN1 | Growth Inhibition Assay | IC50=4.75 ± 0.62 μM | 23443805 | |||
| SNGII | Growth Inhibition Assay | IC50=4.29 ± 0.58 μM | 23443805 | |||
| ISHIKAWA | Growth Inhibition Assay | IC50=5.48 ± 0.03 μM | 23443805 | |||
| HEC1A | Growth Inhibition Assay | IC50=10.00 ± 1.00 μM | 23443805 | |||
| KLE | Growth Inhibition Assay | IC50=3.03 ± 0.11 μM | 23443805 | |||
| SNGM | Growth Inhibition Assay | IC50=5.00 ± 0.41 μM | 23443805 | |||
| USPC2 | Growth Inhibition Assay | IC50=7.00 ± 0.21 μM | 23443805 | |||
| EN | Growth Inhibition Assay | IC50=6.03 ± 0.31 μM | 23443805 | |||
| MFE319 | Growth Inhibition Assay | IC50=5.37 ± 0.03 μM | 23443805 | |||
| EFE184 | Growth Inhibition Assay | IC50=8.04 ± 0.69 μM | 23443805 | |||
| ECC1 | Growth Inhibition Assay | IC50=6.74 ± 0.59 μM | 23443805 | |||
| HEC1B | Growth Inhibition Assay | IC50=6.45 ± 0.67 μM | 23443805 | |||
| USPC1 | Growth Inhibition Assay | IC50=5.75 ± 0.50 μM | 23443805 | |||
| SPAC1L | Growth Inhibition Assay | IC50=4.92 ± 0.50 μM | 23443805 | |||
| HCC827 | Function assay | Displacement of [3H]-cyclopamine from SMO V404M mutant in gefitinib resistant human HCC827 cells by scintillation counting, Ki = 0.0465 μM. | 28787156 | |||
| SJ-GBM2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SJ-GBM2 cells | 29435139 | |||
| NB-EBc1 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB-EBc1 cells | 29435139 | |||
| sf9 | Function assay | 60 mins | Inhibition of non-phosphorylated N-terminal His6-tagged FGFR4 C552A mutant (G442 to E753 residues) (unknown origin) expressed in sf9 cells using 5-Fluo-Ahx-KKKKEEIYFFFG-NH2 as substrate after 60 mins by microfluidic mobility shift assay, IC50 = 0.00082 μM. | ChEMBL | ||
| sf9 | Function assay | 60 mins | Inhibition of wild type non-phosphorylated N-terminal His6-tagged FGFR4 (G442 to E753 residues) (unknown origin) expressed in sf9 cells using 5-Fluo-Ahx-KKKKEEIYFFFG-NH2 as substrate after 60 mins by microfluidic mobility shift assay, IC50 = 0.062 μM. | ChEMBL | ||
| sf9 | Function assay | 60 mins | Inhibition of non-phosphorylated N-terminal His6-tagged FGFR4 C477A mutant (G442 to E753 residues) (unknown origin) expressed in sf9 cells using 5-Fluo-Ahx-KKKKEEIYFFFG-NH2 as substrate after 60 mins by microfluidic mobility shift assay, IC50 = 0.064 μM. | ChEMBL | ||
| Klik om meer experimentele gegevens over de cellijn te bekijken | ||||||
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 560.48 | Formule | C26H31Cl2N7O3 |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 872511-34-7 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | NVP-BGJ398 | Smiles | CCN1CCN(CC1)C2=CC=C(C=C2)NC3=CC(=NC=N3)N(C)C(=O)NC4=C(C(=CC(=C4Cl)OC)OC)Cl | ||
Oplosbaarheid
|
In vitro |
DMSO
: 3 mg/mL
(5.35 mM)
Water : Insoluble Ethanol : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
FGFR1
(Cell-free assay) 0.9 nM
FGFR3
(Cell-free assay) 1.0 nM
FGFR2
(Cell-free assay) 1.4 nM
FGFR3 (K650E)
(Cell-free assay) 4.9 nM
FGFR4
(Cell-free assay) 60 nM
|
|---|---|
| In vitro |
Infigratinib (BGJ398) voorkomt ook VEGFR2 met een lage potentie, met een IC50 van 0,18 μM voor het remmen van dit doelwit. Het onderdrukt andere kinasen, waaronder ABL, FYN, KIT, LCK, LYN en YES, met IC50-waarden van respectievelijk 2,3 μM, 1,9 μM, 0,75 μM, 2,5 μM, 0,3 μM en 1,1 μM. Op cellulair niveau remt deze verbinding de proliferatie van de FGFR1-, FGFR2-Q- en FGFR3-afhankelijke BaF3-cellen met een IC50 van respectievelijk 2,9 μM, 2,0 μM en 2 μM. Het interfereert met autofosforylering op specifieke tyrosineresiduen, waaronder FGFR-WT, FGFR2-WT, FGFR3-K650E, FGFR3-S249C en FGFR4-WT, met een IC50 van respectievelijk 4,6 nM, 4,9 nM, 5 nM, 5 nM en 168 nM. Bovendien onderdrukt het de proliferatie van kankercellen met wildtype (WT) FGFR3-overexpressie, zoals RT112, RT4, SW780 en JMSU1, met een IC50 van respectievelijk 5 nM, 30 nM, 32 nM en 15 nM.
|
| Kinase Assay |
Radiometrische kinase-assay
|
|
De enzymatische kinaseactiviteit wordt beoordeeld door de fosforylering van een synthetisch substraat te meten door het gezuiverde GST-fusie FGFR3-K650E kinase-domein, in aanwezigheid van radiogemerkt ATP. Enzymactiviteiten worden gemeten door 10 μL van een 3-voudig geconcentreerde oplossing van Infigratinib (BGJ398) of controle te mengen met 10 μL van het corresponderende substraatmengsel (peptidisch substraat, ATP en [γ33P]ATP). De reacties worden geïnitieerd door toevoeging van 10 μL van een 3-voudig geconcentreerde oplossing van het enzym in assaybuffer. De uiteindelijke concentraties van de assaycomponenten zijn als volgt: 10 ng GST-FGFR3-K650E, 20 mM Tris-HCl, pH 7,5, 3 mM MnCl2, 3 mM MgCl2, 1 mM DTT, 250 μg/mL PEG 20000, 2 μg/mL poly(EY) 4:1, 1% DMSO en 0,5 μM ATP (γ-[33P]-ATP 0,1 μCi). De assay wordt uitgevoerd volgens de filterbindingsmethode (FB) in 96-well platen bij kamertemperatuur gedurende 10 minuten in een eindvolume van 30 μL, inclusief deze verbinding. De enzymatische reacties worden gestopt door toevoeging van 20 μL 125 mM EDTA, en de incorporatie van 33P in de polypeptidische substraten wordt gekwantificeerd als volgt: 30 μL van het gestopte reactiemengsel wordt overgebracht op Immobilon-PVDF-membranen die eerder gedurende 5 minuten waren geweekt in methanol, gespoeld met water, gedurende 5 minuten geweekt in 0,5% H3PO4, en gemonteerd op een vacuümverdeelstuk met losgekoppelde vacuümbron. Na het spotten wordt vacuüm aangesloten en wordt elk putje gespoeld met 0,5% H3PO4 (200 μL). Vrije membranen worden verwijderd en vier keer op een schudapparaat gewassen met 1% H3PO4 en één keer met ethanol. Membranen worden gedroogd en bedekt met toevoeging van 10 μL/putje van een scintillatievloeistof. De platen worden uiteindelijk verzegeld en geteld in een microplaat-scintillatieteller. IC50-waarden worden berekend door lineaire regressieanalyse van het percentage remming ervan.
|
|
| In vivo |
In dit orthotope xenograft blaaskankermodel induceert BGJ398 tumorremming en stasis na orale toediening gedurende 12 opeenvolgende dagen bij doses van respectievelijk 10 en 30 mg/kg. Interessant is dat de dieren die deze verbinding kregen, ofwel geen gewichtsverlies (10 mg/kg) ofwel 10% gewichtstoename (30 mg/kg) vertonen, een verdere indicatie van werkzaamheid. RT112-tumor dragende en vrouwelijke Rowett-ratten krijgen een enkele orale toediening van het monofosfaatzout van Infigratinib (BGJ398) in doses van 4,25 en 8,51 mg/kg. Het verlaagt de niveaus van pFRS2 en pMAPK significant op een dosisafhankelijke manier. Bovendien remt het significant bFGF-gestimuleerde Angiogenesis op een dosisafhankelijke manier. Het belemmert echter niet VEGF-geïnduceerde bloedvatvorming.
|
Referenties |
Toepassingen
| Methoden | Biomarkers | Afbeeldingen | PMID |
|---|---|---|---|
| Western blot | pFGFR1 / FGFR1 / pFRS2 / FRS2 / MEK / ERK p-YAP (S127) / YAP Mcl-1 Cyclin D1 / Cyclin A / Cyclin B / γ-H2AX / Cleaved caspase-9 / PARP Snail / Slug / ZEB1 p-FRS2 / FRS2 / p-AKT / AKT / p-ERK / ERK |
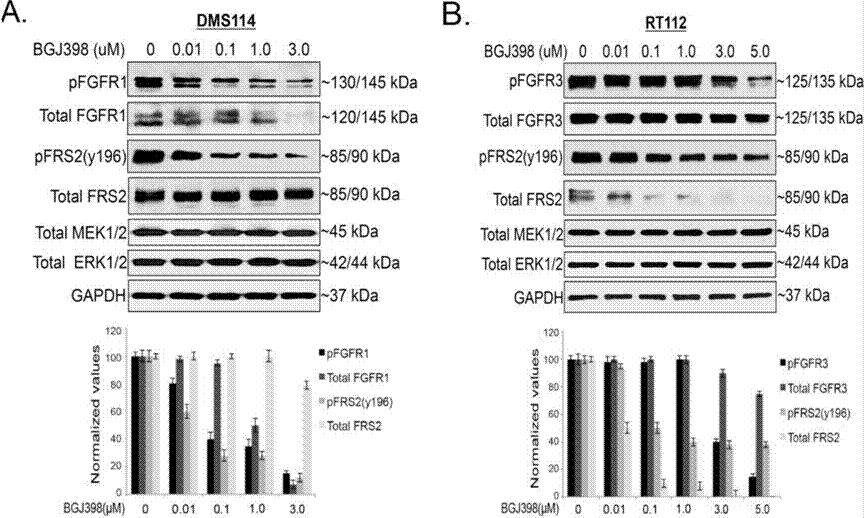
|
28255027 |
| Immunofluorescence | YAP |
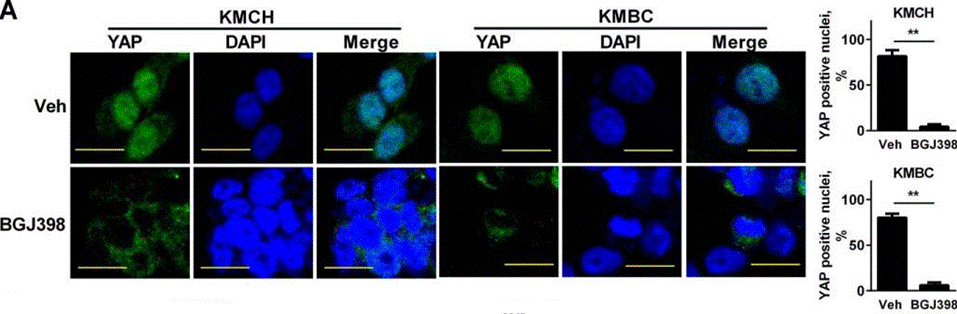
|
26826125 |
| Growth inhibition assay | Cell viability IC50 |
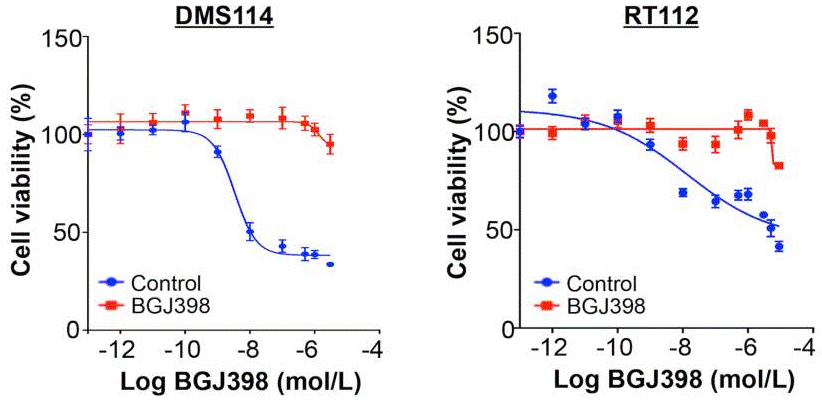
|
28255027 |
Informatie klinische proef
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Rekrutering | Aandoeningen | Sponsor/Medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT03510455 | Terminated | Tumor-Induced Osteomalacia|Oncogenic Osteomalacia |
National Institute of Dental and Craniofacial Research (NIDCR)|National Institutes of Health Clinical Center (CC) |
February 27 2019 | Phase 2 |
| NCT02312804 | Withdrawn | Cancer of Cervix|Tumors |
The University of Texas Health Science Center at San Antonio |
January 2015 | Phase 1 |
| NCT02160041 | Terminated | Solid Tumor|Hematologic Malignancies |
Novartis Pharmaceuticals|Novartis |
July 24 2014 | Phase 2 |
| NCT01928459 | Completed | Advanced Solid Tumors|Metastatic Solid Tumors |
Novartis Pharmaceuticals|Novartis |
October 2013 | Phase 1 |
| NCT01004224 | Completed | Advanced Solid Tumors With Alterations of FGFR1 2 and or 3|Squamous Lung Cancer With FGFR1 Amplification|Bladder Cancer With FGFR3 Mutation or Fusion|Advanced Solid Tumors With FGFR1 Amplication|Advanced Solid Tumors With FGFR2 Amplication|Advanced Solid Tumors With FGFR3 Mutation |
Novartis Pharmaceuticals|Novartis |
December 11 2009 | Phase 1 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
Veelgestelde vragen
Vraag 1:
If you have any suggestions about the formulation of this compound for a direct oral gavage administration?
Antwoord:
It can be dissolved in 30% PEG400/0.5% Tween80/5% Propylene glycol at 30 mg/ml as a suspension.
