uitsluitend voor onderzoeksdoeleinden
Indomethacin COX remmer
Cat.Nr.S1723
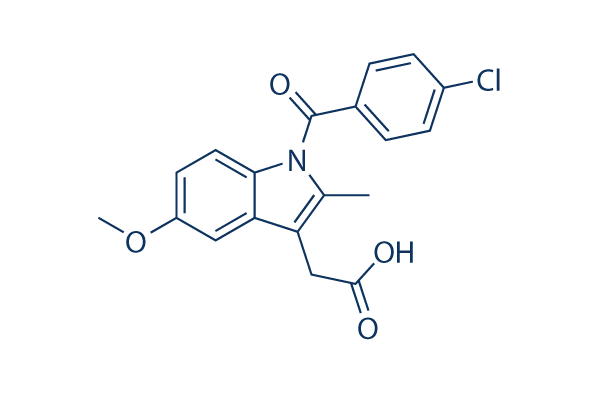
Chemische structuur
Moleculair gewicht: 357.79
Kwaliteitscontrole
| Gerelateerde doelwitten | Adrenergic Receptor AChR 5-HT Receptor Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Overige COX Inhibitoren | NS-398 (NS398) Paeoniflorin (NSC 178886) Lumiracoxib Xanthohumol Bufexamac Nimesulide Ginsenoside Rd Pranoprofen Phenacetin Tolfenamic Acid |
Celkweek, behandeling & werkconcentratie
| Cellijnen | Assaytype | Concentratie | Incubatietijd | Formulering | Activiteitsbeschrijving | PMID |
|---|---|---|---|---|---|---|
| HeLa cells | Function assay | 20 mins | Agonist activity at androgen receptor (unknown origin) expressed in HeLa cells co-expressing PSA-(ARE)4-Luc13 assessed as induction of DHT-induced luciferase activity after 20 mins by luciferase reporter gene assay, EC50=0.14 nM | |||
| J774 cells | Function assay | In vitro inhibitory activity against Prostaglandin G/H synthase 1 in murine J774 cells, IC50=2 nM | ||||
| U-937 cells | Function assay | In vitro inhibitory activity against human Prostaglandin G/H synthase 1 (COX-1) in U-937 cells, IC50=2 nM | ||||
| rat synovial cells | Function assay | In vitro inhibitory effect on production of prostaglandin E2 (PGE2) in rat synovial cells, IC50=2.9 nM | ||||
| 143982 cells | Function assay | In vitro inhibitory activity against human Prostaglandin G/H synthase 2 (COX-2) in 143982 cells, IC50=9 nM | ||||
| CHO cells | Function assay | In vitro inhibitory potency against human COX-1 in stably transfected chinese hamster ovary (CHO) cells, IC50=18 nM | ||||
| RBL-1 cell line | Function assay | Inhibition of Prostaglandin G/H synthase in intact RBL-1 cell line, IC50=0.5 μM | ||||
| SF-9 insect cells | Function assay | 20 Mins | Inhibition of human COX2 expressed in SF-9 insect cells assessed as conversion of [14C]-arachidonic acid to [14C]-prostaglandins preincubated for 20 mins by thin-layer chromatography analysis, IC50=0.75 μM | |||
| mouse RAW264.7 cells | Function assay | 24 h | Antiinflammatory activity in mouse RAW264.7 cells assessed as inhibition of LPS-induced NO production after 24 hrs by Griess assay, IC50=1.25 μM | |||
| mouse BV2 cells | Function assay | 24 h | Antiinflammatory activity in mouse BV2 cells assessed as inhibition of LPS-induced NO production after 24 hrs by Griess assay, IC50=7.1 μM | |||
| human 2008 cells | Function assay | Inhibition of human MRP1 in human 2008 cells, IC50=12 μM | ||||
| A549 cells | Function assay | 10 μM | Inhibition of mPGES1 in human A549 cells assessed as inhibition of IL-1-beta-induced PGE2 formation at 10 uM by cell-intact assay | |||
| HepG2 cells | Function assay | 100 μM | Inhibition of MRP1-mediated doxorubicin efflux in doxorubicin resistant human HepG2 cells at 100 uM by flow cytometry | |||
| THP1 cells | Function assay | 100 μM | 30 mins | Irreversible inhibition of COX-1 in human THP1 cells assessed as inhibition of arachidonic acid-induced TXB2 formation at 100 uM incubated for 30 mins followed by compound washout measured 30 mins post arachidonic acid challenge by radioimmunoassay | ||
| MDA-MB-231 cells | Function assay | 100 μM | 30 mins | Irreversible inhibition of COX-1 in human MDA-MB-231 cells assessed as inhibition of arachidonic acid-induced PGE2 formation at 100 uM incubated for 30 mins followed by compound washout measured 30 mins post arachidonic acid challenge by radioimmunoassay | ||
| LNCAP cells | Function assay | 30 μM | 48 h | Inhibition of AKR1C3 (unknown origin)-mediated testosterone-17beta-glucuronide formation expressed in human LNCAP cells at 30 uM after 48 hrs in presence of 4-androstene-3,17-dione | ||
| mouse BV2 cells | Cytotoxicity assay | 24 h | Cytotoxicity against mouse BV2 cells assessed as maximum non-toxic concentration after 24 hrs by MTT assay | |||
| Klik om meer experimentele gegevens over de cellijn te bekijken | ||||||
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 357.79 | Formule | C19H16ClNO4 |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 53-86-1 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | Indometacin,NSC-77541 | Smiles | CC1=C(C2=C(N1C(=O)C3=CC=C(C=C3)Cl)C=CC(=C2)OC)CC(=O)O | ||
Oplosbaarheid
|
In vitro |
DMSO
: 72 mg/mL
(201.23 mM)
Ethanol : 24 mg/mL Water : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
COX1
0.28 μM
COX-2
14 μM
|
|---|---|
| In vitro |
Indomethacin remt de transcriptie van een bèta-catenine/TCF-responsief reportergen op een dosisafhankelijke manier. Deze verbinding reguleert ook het bèta-catenine/TCF transcriptionele doelwit cycline D1 neerwaarts. Het vermindert de transcriptie van bèta-catenine/TCF-responsieve genen, door de TCF-activiteit te moduleren zonder de bèta-catenine/TCF-complexvorming te verstoren.
|
| In vivo |
Indomethacin verhoogt BrdU+-cellen van alle lineages en vermindert microgliale/monocytaire activering bij ratten na focale cerebrale ischemie. Deze verbinding (7,5 mg/kg, één injectie) veroorzaakt acute schade en ontsteking in het distale jejunum en proximale ileum die maximaal zijn na drie dagen en volledig verdwijnen binnen één week. Het (twee dagelijkse subcutane injecties) produceert een meer uitgebreide en chronische ontsteking die in meer dan 75% van de ratten gedurende ten minste twee weken in een actieve vorm aanhoudt. Deze chemische stof (4ppm) vermindert de tumoropbrengst met 78% bij SKH:HR-1-hrBr haarloze muizen. Het (20 mg/kg, oraal) verhoogt het totale oppervlak van maagzweren en de concentratie van lipideperoxides in het maagslijmvlies van ratten. Deze verbinding verhoogt de alfa-tocoferol:totaal cholesterol-ratio in serum. Het remt de toename van maagzweren en lipideperoxides in het maagslijmvlies, en de vermindering van serum-alfa-tocoferol.
|
Referenties |
|
Informatie klinische proef
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Rekrutering | Aandoeningen | Sponsor/Medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT06031363 | Completed | Pancreatitis|Cholangiopancreatography Endoscopic Retrograde|Indomethacin |
The First Affiliated Hospital of Soochow University |
November 1 2022 | Not Applicable |
| NCT04821323 | Completed | Healthy |
Janssen Research & Development LLC |
March 10 2021 | Early Phase 1 |
| NCT04025177 | Withdrawn | Patent Ductus Arteriosus After Premature Birth |
University of Manitoba|St. Boniface Hospital|Health Sciences Centre Winnipeg Manitoba|University at Buffalo |
January 2020 | Phase 2 |
| NCT03967483 | Unknown status | Headache Migraine |
Anne Ducros|French Society for the Study of Migraine Headache |
June 1 2019 | -- |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
