réservé à la recherche
PNU-120596 AChR modulateur
N° Cat.S2629
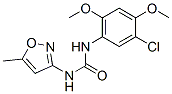
Structure chimique
Poids moléculaire: 311.72
Contrôle qualité
Informations chimiques, stockage et stabilité
| Poids moléculaire | 311.72 | Formule | C13H14ClN3O4 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 501925-31-1 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | Nsc 216666 | Smiles | CC1=CC(=NO1)NC(=O)NC2=CC(=C(C=C2OC)OC)Cl | ||
Solubilité
|
In vitro |
DMSO
: 62 mg/mL
(198.89 mM)
Ethanol : 1 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
α7 nAChR
216 nM(EC50)
|
|---|---|
| In vitro |
PNU-120596 augmente le flux de calcium évoqué par l'agoniste (Ach) médié par une variante ingénierie du récepteur α7 nAChR humain. Ce composé augmente les courants évoqués par les agonistes (choline et ACh) médiés par les récepteurs de type sauvage et démontre également une prolongation prononcée de la réponse évoquée en présence continue de l'agoniste dans les ovocytes de Xenopus. Il augmente le temps d'ouverture moyen du canal des α7 nAChR mais n'a aucun effet sur la sélectivité ionique et relativement peu, voire pas du tout, d'effet sur la conductance unitaire. Lorsqu'il est appliqué à des tranches hippocampiques aiguës, ce produit chimique augmente la fréquence des courants postsynaptiques GABAergiques évoqués par l'ACh mesurés dans les neurones pyramidaux ; cet effet est supprimé par le TTX, suggérant qu'il module la fonction des α7 nAChR situés sur la membrane somatodendritique des interneurones hippocampiques. Outre la modulation positive de l'α7 nAChR, ce composé induit un profond retardement de la cinétique de désensibilisation, augmentant le potentiel de toxicité induite par le Ca2+ par une stimulation excessive de l'α7 nAChR. Il provoque des changements dans l'accessibilité de la cystéine au niveau du feuillet bêta interne, de la zone de transition et du site de liaison de l'agoniste lors de sa liaison à l'α7 nAChR. Les sites de liaison pour ce produit chimique ne se trouvent pas dans les sites de liaison de l'agoniste et il améliore la régulation du gating évoquée par l'agoniste des récepteurs nicotiniques en déclenchant des effets conformationnels similaires mais non identiques aux conformations de gating favorisées par l'Ach.
|
| Kinase Assay |
Essai de fluorescence Ca2+
|
|
Les cellules épithéliales humaines SH-EP1 exprimant une variante de l'α7 nAChR (α7*) sont cultivées dans un milieu essentiel minimal (MEM) contenant des acides aminés non essentiels, complété par 10 % de sérum de veau fœtal, de L-glutamine, 100 U/ml de pénicilline/streptomycine, 250 ng/mL de fungizone, 400 μg/mL d'hygromycine B et 800 μg/mL de généticine. α7* est une variante du α7 nAChR humain, avec deux mutations ponctuelles dans le premier domaine transmembranaire (T230P et C241S) qui permettent une expression fonctionnelle élevée dans les cellules SH-EP1 [Groppi VE, Wolfe ML, Berkenpas MB (2003) U.S. Patent 6,693,172 B1]. Les cellules sont cultivées dans un incubateur à 37 °C avec 6 % de CO2. Les cellules sont trypsinées et plaquées dans des plaques à 96 puits avec des parois latérales sombres et des fonds clairs à une densité de 2 × 104 cellules/puits 2 jours avant l'analyse. Les cellules sont chargées avec un mélange de Calcium reen-1AM dans du diméthylsulfoxyde anhydre et 20 % de pluronic F-127. Ce réactif est ajouté directement au milieu de croissance de chaque puits pour atteindre une concentration finale de 2 μM de Calcium Green-1 AM. Les cellules sont ensuite incubées dans le colorant pendant 1 heure à 37 °C, puis lavées quatre fois avec la solution saline équilibrée de Earle modifiée de Mark (MMEBSS) composée des éléments suivants (en mM) : 4 CaCl2, 0.8 MgSO4, 20 NaCl, 5.3 KCl, 5.6 D-glucose, 20 Tris-HEPES et 120 N-méthyl-D-glucamine, pH 7.4. Après le quatrième cycle, les cellules sont laissées à incuber à 37 °C pendant au moins 10 minutes. Le volume final de MMEBSS dans chaque puits est de 100 μL et de l'atropine est ajoutée à tous les puits pour une concentration finale de 1 μM. Un lecteur de plaques d'imagerie fluorométrique (FLIPR ; Molecular Devices, Union City, CA) est configuré pour exciter le Calcium Green à 488 nm en utilisant 500 mW de puissance et en lisant l'émission de fluorescence >525 nm. Une exposition de 0,5 seconde est utilisée pour illuminer chaque puits. La fluorescence est détectée à l'aide d'un ensemble de diaphragmes F de 2,0 ou 1,2. Après 30 secondes d'enregistrement de base, les composés d'essai sont ajoutés à chaque puits d'une plaque à 96 puits dans 50 μL d'une solution stock 3 ×. Dans chaque expérience, quatre puits sont utilisés comme contrôles du véhicule (0,2 % de DMSO).
|
|
| In vivo |
L'administration systémique de PNU-120596 (1 mg/kg) à des rats améliore le déficit de gating auditif causé par l'amphétamine, un modèle proposé pour refléter une perturbation au niveau du circuit associée à la schizophrénie. Lorsqu'il est administré avant la carragénine, 30 mg/kg de ce composé atténuent significativement l'hyperalgésie mécanique et les déficits de support de poids pendant une durée allant jusqu'à 4 heures. Ce produit chimique atténue l'augmentation induite par la carragénine des niveaux de TNF-α et d'IL-6 dans l'œdème de la patte arrière ; le diclofénac n'a atténué que les niveaux d'IL-6. L'hyperalgésie mécanique établie induite par la carragénine ou la CFA est également partiellement inversée par cet agent.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
