réservé à la recherche
NVP-BSK805 2HCl JAK inhibiteur
N° Cat.S2686
Structure chimique
Poids moléculaire: 563.47
Contrôle qualité
| Cibles apparentées | EGFR STAT Pim |
|---|---|
| Autre JAK Inhibiteurs | BMS-986165 (Deucravacitinib) AZD1480 WP1066 Momelotinib (CYT387) Filgotinib (GLPG0634) AT9283 Gandotinib (LY2784544) Pacritinib TG101209 Cerdulatinib (PRT062070) hydrochloride |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 563.47 | Formule | C27H28F2N6O.2HCl |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1942919-79-0 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | BSK805 | Smiles | C1CNCCC1N2C=C(C=N2)C3=NC4=C(C=CC=C4N=C3)C5=CC(=C(C(=C5)F)CN6CCOCC6)F.Cl.Cl | ||
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(177.47 mM)
Water : 100 mg/mL Ethanol : 6 mg/mL |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
JAK2
(Cell-free assay) ~0.5 nM
TYK2
(Cell-free assay) 10.76 nM
JAK3
(Cell-free assay) 18.68 nM
JAK1
(Cell-free assay) 31.63 nM
|
|---|---|
| In vitro |
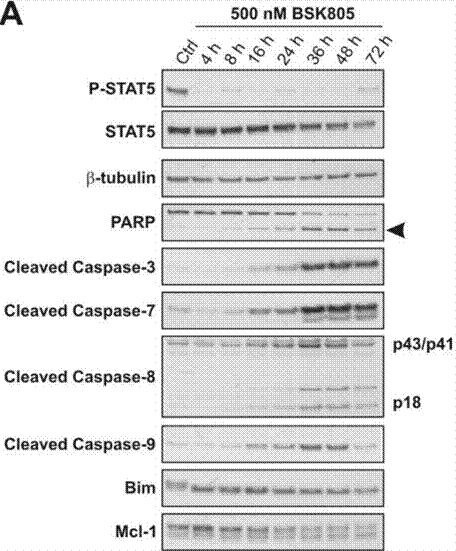
NVP-BSK805 s'avère inhiber puissamment JAK2, tout en présentant une sélectivité plus de 20 fois supérieure envers JAK1, JAK3 et TYK2. NVP-BSK805 provoque une inhibition semi-maximale des enzymes JAK2V617F pleine longueur et JAK2 de type sauvage à 0,5 nM. NVP-BSK805 bloque la croissance des cellules JAK2V617F (Ba/F3) et induit l'apoptose avec une GI50 à des concentrations <100 nM. La phosphorylation constitutive de STAT5 étant dépendante de JAK2, NVP-BSK805 s'avère supprimer puissamment la phosphorylation de STAT5 à des concentrations ≥ 100 nM dans les lignées cellulaires mutantes JAK2V617F, telles que MB-02. L'incubation de cellules SET-2 avec 150 nM et 1 µM de NVP-BSK805, ce qui correspond respectivement aux concentrations entraînant une inhibition de croissance de 75 % et 95 %, pendant 24, 48 et 72 heures, conduit à une induction d'apoptose dépendante de la concentration et du temps. Ces résultats sont mis en évidence par la détection de PARP clivé, une expression réduite de Bcl-xL et une forte augmentation du nombre de cellules avec moins de 2N de contenu d'ADN. La mort cellulaire déclenchée par NVP-BSK805 nécessite l'activation des cascades de caspases et est surmontée par l'inhibition des caspases dans les cellules SET-2 et MB-02. NVP-BSK805 module la modification post-traductionnelle de Bim et les niveaux de Mcl-1 dans les cellules JAK2V617F, les cellules SET-2 et MB-02.
|
| Kinase Assay |
Essais enzymatiques
|
|
Le domaine kinase JAK2 humain (acides aminés 840-1132) est contenu dans le plasmide pAcG2TtevJAK2. Les constructions plasmidiques pour JAK3 (813-1124), TYK2 (888-1187) et JAK1 (866-1154) sont conçues. La génération des baculovirus recombinants avec de l'ADN linéarisé BD BaculoGoldTM Bright, l'essai de plages et l'amplification virale à partir de plages uniques sont effectués selon le manuel (BD Biosciences Pharmingen). Les domaines de Janus kinase sont exprimés dans des cellules Sf9 dans des flacons agités de 400 mL avec 100 mL de milieu de culture ExCell420 (JRH Biosciences Ltd) avec une solution de pénicilline/streptomycine pendant 48 h à 27°C. Les cellules en culture de suspension sont infectées à une densité de 1 × 106 et la multiplicité d'infection (MOI) pour chaque virus est optimisée pour le rendement en protéine soluble. Le domaine kinase de JAK2 humain et de JAK1, JAK3 et TYK2 est exprimé à une MOI de 1 et 0,5, respectivement. Le temps d'expression à 27°C est de 48 heures pour JAK2 et de 48 heures ou 72 heures pour JAK1, JAK3 et TYK2. Quarante-huit ou soixante-douze heures après l'infection, les cellules d'une culture d'expression de 100 mL sont récoltées par centrifugation à 3000 x g pendant 5 minutes et lysées avec 12 mL de tampon de lyse (50 mM Tris-HCl, pH 7,5, 150 mM NaCl, 2 mM EDTA, 1 mM DTT, 1 mM orthovanadate de sodium, 1 % Triton X-100, 10 % glycérol, 1 x cocktail d'inhibiteurs de protéase complet sans EDTA (Roche Diagnostics) et 12,5 U/mL Benzonase pendant 30 minutes à 4°C, suivi d'une centrifugation à 14 000 × g pendant 45 minutes pour précipiter le matériel insoluble. Pour la purification par affinité de protéines de domaines kinase marquées GST, toutes les étapes sont effectuées à 4°C. Les lysats clarifiés sont incubés avec 0,2 mL d'une suspension à 50 % de Glutathione Sepharose 4B lavée pendant 2 heures à 4°C, suivi de 5 lavages avec 1 mL de 50 mM Tris-HCl, pH 7,5, 150 mM NaCl, 0,1 % Triton X-100, 1 mM DTT et 10 % glycérol. La protéine liée est éluée en 5 aliquotes, chacune commençant par une incubation de 10 minutes avec 0,25 mL de tampon d'élution (50 mM Tris-HCl, pH 7,5, 150 mM NaCl, 0,1 % Triton X-100, 1 mM DTT, 10 % glycérol, 10 mM L-glutathion réduit). Les éluats sont concentrés environ 5 fois avec des colonnes de centrifugation Amicon Ultra-4. Après addition de Brij35 à une concentration finale de 0,1 %, la protéine est congelée rapidement en petites aliquotes et stockée à -80 °C. Dans ces conditions, les activités kinase sont stables pendant au moins 6 mois. Les enzymes du domaine kinase JAK sont incubées pendant 30 minutes à température ambiante dans un milieu contenant 0,1 μM [γ33P]-ATP, 1 mM MnCl2, 5 mM MgCl2, 30 μM de substrat peptidique synthétique EQEDEPEGDYFEWLE, 1 mM DTT, 1 % DMSO, 50 μg/mL BSA, 0,01 % Brij35 et 50 mM Tris-HCl pH 7,5. La concentration d'ATP est inférieure au Km pour toutes les protéines. Les courbes sont ajustées par régression non linéaire en utilisant l'équation logistique et la fonction d'ajustement global de XLfit® (modèle 205). L'expression et la caractérisation des JAK2 de type sauvage et mutant V617F pleine longueur, ainsi que les conditions d'essai kinase, ont été décrites ailleurs. La sélectivité kinase de NVP-BSK805 est évaluée dans un panel kinase interne : Dans les essais Caliper, les réactions kinase sont réalisées avec des substrats peptidiques qui migrent à des vitesses différentes dans un champ électrique lorsqu'ils sont phosphorylés. Les peptides portent un marqueur fluorescent pour permettre la détection et la quantification des peptides dans un système capillaire. Les intensités de fluorescence des peptides sont quantifiées à l'aide de l'instrument LC3000 (Caliper Life Sciences, Hopkinton, MA, États-Unis). L'activité kinase est mesurée en quantifiant la quantité d'ATP restant en solution après une réaction kinase. Dans les essais kinase LanthaScreen™ TR-FRET, le terbium est utilisé comme chélate de lanthanide combiné à un anticorps dirigé contre le substrat phosphorylé.
|
|
| In vivo |
La biodisponibilité orale de NVP-BSK805 chez les souris est estimée à 45 %, tandis qu'elle est de 50 % chez les rats. L'administration orale de NVP-BSK805 à 150 mg/kg supprime la phosphorylation de STAT5, la splénomégalie et la propagation des cellules leucémiques dans un modèle murin piloté par des cellules Ba/F3 JAK2V617F. NVP-BSK805 supprime la phosphorylation de STAT5 induite par la rhEpo ainsi que la polyglobulie et la splénomégalie médiées par la rhEpo chez des souris BALB/c à des doses de 25, 50 et 100 mg/kg par voie orale.
|
Références |
|
Applications
| Méthodes | Biomarqueurs | Images | PMID |
|---|---|---|---|
| Western blot | p-STAT5 / STAT5 / PARP / Cleaved Caspase-3 / Cleaved caspase-7 / Cleaved Caspase-8 / Cleaved Caspase-9 / Bim / Mcl-1 p-JAK2 / JAK2 |
|
21247487 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
