réservé à la recherche
Ginkgolide B PAFR antagoniste
N° Cat.S1343
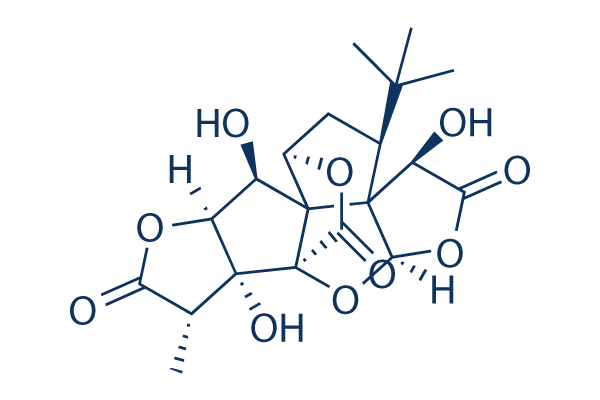
Structure chimique
Poids moléculaire: 424.4
Contrôle qualité
Informations chimiques, stockage et stabilité
| Poids moléculaire | 424.4 | Formule | C20H24O10 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 15291-77-7 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | BN52021 | Smiles | CC1C(=O)OC2C1(C34C(=O)OC5C3(C2O)C6(C(C5)C(C)(C)C)C(C(=O)OC6O4)O)O | ||
Solubilité
|
In vitro |
DMSO
: 85 mg/mL
(200.28 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
PAFR
3.6 μM
|
|---|---|
| In vitro |
Le Ginkgolide B inhibe puissamment un récepteur du facteur d'activation plaquettaire (PAF). Le traitement des PMN avec ce composé (0,5 μM -12 μM) stimule une production rapide et faible d'espèces réactives de l'oxygène déterminée par chimioluminescence. Il potentialise la réponse CL induite par le fMet-Leu-Phe et le zymosan. Cette substance chimique induit la différenciation des cellules kystiques et altère la voie de signalisation Ras/MAPK. Elle favorise la prolifération et l'expression génique endothéliale, et améliore considérablement la réponse migratoire induite par le facteur de croissance endothélial vasculaire et la capacité à s'incorporer dans les réseaux vasculaires des EPC. Elle protège les EPC de la mort cellulaire induite par le H2O2. Elle induit la phosphorylation de l'eNOS, de l'Akt et de la p38, ce qui favorise à son tour la prolifération et la fonction cellulaires.
|
| In vivo |
Le Ginkgolide B (2 μM) inhibe significativement la formation de kystes MDCK de manière dose-dépendante, avec une réduction allant jusqu'à 69 %. Ce composé inhibe également significativement l'élargissement des kystes dans le modèle de kyste MDCK, le modèle de kyste rénal embryonnaire et le modèle de souris PKD. L'application pré-ischémique de ce composé (50 mg/kg p.o.) réduit significativement les dommages neuronaux. 30 minutes de prétraitement avec cette substance chimique (100 mg/kg, s.c.) réduit la zone d'infarctus dans le modèle de souris d'ischémie focale. Dans les cultures primaires de neurones hippocampiques et d'astrocytes de rats nouveau-nés, ce composé (1 μM) protège les neurones contre les dommages causés par le glutamate. Il (100 μM) réduit les dommages apoptotiques induits par la staurosporine. Chez les animaux anesthésiés au pentobarbitone ou à l'éthylcarbamate, ce composé (1 mg/kg i.v. ou 10 mg/kg p.o.) inhibe la bronchoconstriction, l'augmentation de l'hématocrite et la thrombopénie et leucopénie associées induites par le PAF-acéther (33 ng/kg-100 ng/kg). À une dose de 3 mg/kg, il réduit la bronchoconstriction induite par le PAF-acéther en aérosol. Ce composé à une dose de 300 μM inhibe également la production de superoxyde par les macrophages alvéolaires stimulés par le PAF-acéther. Il bloque la formation de thromboxane déclenchée par le PAF-acéther (100 ng) injecté dans le poumon perfusé. Le prétraitement de bandes de parenchyme pulmonaire avec cette substance chimique (100 μM) inhibe partiellement la contraction induite par le PAF-acéther (0,1 μM) et supprime la libération concomitante de thromboxane. Ce composé inhibe la maturation des lésions ischémiques. Son traitement révèle une réduction marquée du volume de l'infarctus, de l'œdème cérébral et des déficits neurologiques. Ce composé inhibe également l'activation de NF-κB, de la microglie et la production de cytokines pro-inflammatoires induites par l'ischémie/reperfusion (I/R). Il réduit les niveaux de protéine Bax et augmente les niveaux de protéine Bcl-2 dans les cerveaux post-ischémiques. Cette substance chimique atténue l'agrégation plaquettaire et inhibe l'activation de la phosphatidylinositol 3 kinase (PI3K) et la phosphorylation d'Akt dans les plaquettes activées par la thrombine et le collagène. Elle diminue les niveaux plasmatiques de PF4 et de RANTES chez les souris ApoE−/−. Ce composé diminue l'expression de la P-sélectine, du PF4, du RANTES et du CD40L dans la plaque aortique chez les souris ApoE−/−. De plus, il supprime l'expression des macrophages et de la protéine d'adhésion des cellules vasculaires 1 (VCAM-1) dans les lésions aortiques chez les souris ApoE−/−.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
