Dati tecnici
| Formula | C22H27FN4O2.C4H6O5 |
||||||
| Peso molecolare | 532.56 | Numero CAS | 341031-54-7 | ||||
| Solubilità (25°C)* | In vitro | DMSO | 100 mg/mL (187.77 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Aggiungere i solventi al prodotto singolarmente e in ordine.) |
|
||||||
|
* <1 mg/ml significa leggermente solubile o insolubile. * Si prega di notare che Selleck testa la solubilità di tutti i composti internamente e la solubilità effettiva può differire leggermente dai valori pubblicati. Ciò è normale ed è dovuto a leggere variazioni da lotto a lotto. * Spedizione a temperatura ambiente (I test di stabilità mostrano che questo prodotto può essere spedito senza alcuna misura di raffreddamento.) |
|||||||
Preparazione delle soluzioni stock
Attività biologica
| Descrizione | Sunitinib malate è un inibitore di RTK multi-target che colpisce VEGFR2 (Flk-1) e PDGFRβ con IC50 di 80 nM e 2 nM in saggi acellulari, e inibisce anche c-Kit. Sunitinib Malate inibisce efficacemente l'autofosforilazione di Ire1α. Sunitinib Malate aumenta sia l'apoptosi dipendente dal recettore della morte che l'apoptosi mitocondriale. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Target |
|
||||||||||
| In vitro | Il Sunitinib inibisce potentemente anche Kit e FLT-3. Il Sunitinib è un potente inibitore ATP-competitivo di VEGFR2 (Flk1) e PDGFRβ con Ki di 9 nM e 8 nM, rispettivamente, mostrando una selettività >10 volte superiore per VEGFR2 e PDGFR rispetto a FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl e src. Nelle cellule NIH-3T3 private di siero che esprimono VEGFR2 o PDGFRβ, il Sunitinib inibisce la fosforilazione di VEGFR2 dipendente da VEGF e la fosforilazione di PDGFRβ dipendente da PDGF con IC50 di 10 nM e 10 nM, rispettivamente. Il Sunitinib inibisce la proliferazione delle HUVEC private di siero indotta da VEGF con IC50 di 40 nM, e inibisce la proliferazione delle cellule NIH-3T3 che sovraesprimono PDGFRβ o PDGFRα indotta da PDGF con IC50 di 39 nM e 69 nM, rispettivamente. Il Sunitinib inibisce la fosforilazione di FLT3 wild-type, FLT3-ITD e FLT3-Asp835 con IC50 di 250 nM, 50 nM e 30 nM, rispettivamente. Il Sunitinib inibisce la proliferazione delle cellule MV4;11 e OC1-AML5 con IC50 di 8 nM e 14 nM, rispettivamente, e induce l'apoptosi in modo dose-dipendente. |
||||||||||
| In vivo | Coerentemente con la sostanziale e selettiva inibizione della fosforilazione e della segnalazione di VEGFR2 o PDGFR in vivo, Sunitinib (20-80 mg/kg/giorno) mostra un'ampia e potente attività antitumorale dose-dipendente contro una varietà di modelli di xenotrapianto tumorale inclusi HT-29, A431, Colo205, H-460, SF763T, C6, A375 o MDA-MB-435. La somministrazione di Sunitinib a 80 mg/kg/giorno per 21 giorni porta a una regressione tumorale completa in sei su otto topi, senza ricrescita tumorale durante un periodo di osservazione di 110 giorni dopo la fine del trattamento. Il secondo ciclo di trattamento con Sunitinib rimane efficace contro i tumori che non sono completamente regrediti durante il primo ciclo di trattamento. Il trattamento con Sunitinib determina una significativa diminuzione della MVD tumorale, con una riduzione di circa il 40% nei tumori del glioma SF763T. Il trattamento con SU11248 determina un'inibizione completa della crescita tumorale aggiuntiva di xenotrapianti PC-3M che esprimono luciferasi, nonostante l'assenza di riduzione delle dimensioni del tumore. Il trattamento con Sunitinib (20 mg/kg/giorno) sopprime drasticamente la crescita di xenotrapianti sottocutanei MV4;11 (FLT3-ITD) e prolunga la sopravvivenza nel modello di innesto di midollo osseo FLT3-ITD. |
Protocollo (da riferimento)
| Saggio della chinasi: |
|
|---|---|
| Saggio cellulare: |
|
| Studio sugli animali: |
|
Riferimenti
|
Convalida del prodotto da parte del cliente
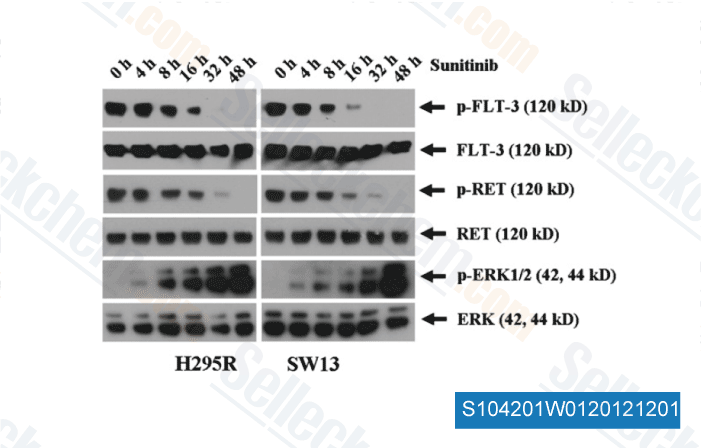
-
Dati da [ Surgery , 2012 , 152, 1045-50 ]
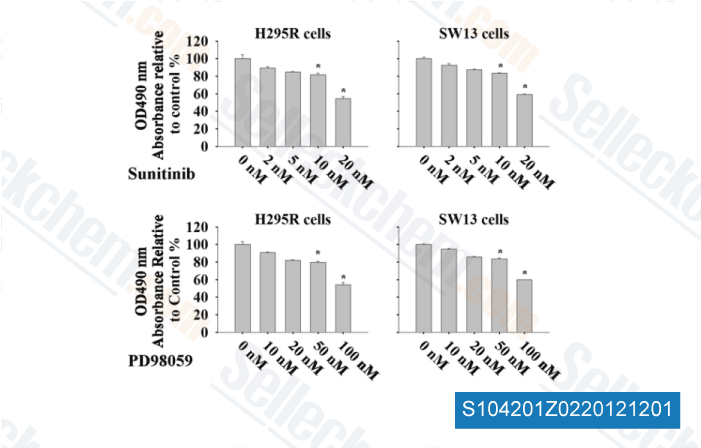
-
Dati da [ Surgery , 2012 , 152, 1045-50 ]
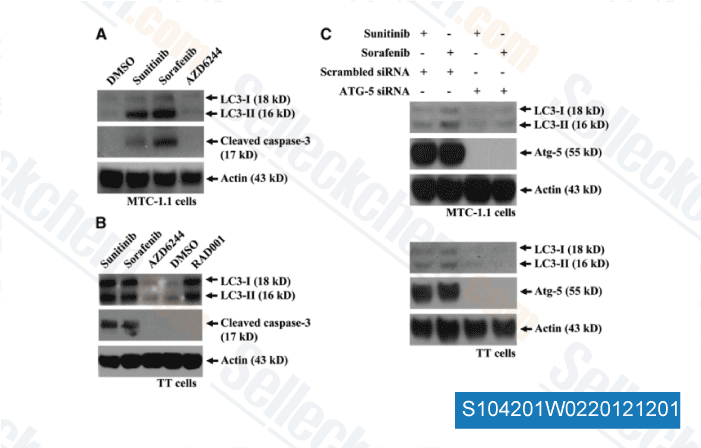
-
Dati da [ Surgery , 2012 , 152, 1142-9 ]
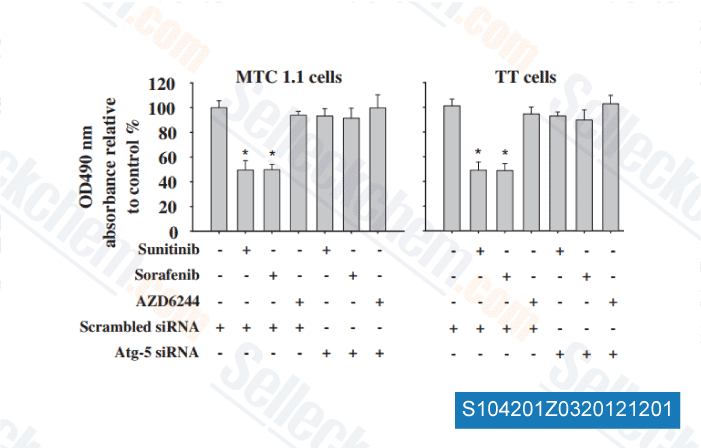
-
Dati da [ Surgery , 2012 , 152, 1142-9 ]
Sellecks Sunitinib (SU11248) Malate È stato citato da 176 Pubblicazioni
| Prolonging lung cancer response to EGFR inhibition by targeting the selective advantage of resistant cells [ Nat Commun, 2025, 16(1):7853] | PubMed: 40846697 |
| Electroacupuncture Prevents Against AD-Like Phenotypes in APP/PS1 Mice: Investigation of the Mechanisms From Cerebral Microangiopathy [ CNS Neurosci Ther, 2025, 31(12):e70696] | PubMed: 41367129 |
| Biofabrication of pheochromocytoma and paraganglioma tumor organoids and assessment of response to systemic therapy [ Sci Rep, 2025, 15(1):35889] | PubMed: 41087622 |
| Overexpression of CSRP1 Suppresses Cell Viability and Enhances the Anti-Cancer Effects of Anti-PD-L1 Therapy in Renal Cell Carcinoma [ Front Biosci (Landmark Ed), 2025, 30(11):46252] | PubMed: 41351404 |
| Establishment, characterization, and biobanking of 36 pancreatic cancer organoids: prediction of metastasis in resectable pancreatic cancer [ Cell Oncol (Dordr), 2024, 10.1007/s13402-024-00939-5] | PubMed: 38619751 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Canthin-6-One Inhibits Developmental and Tumour-Associated Angiogenesis in Zebrafish [ Pharmaceuticals (Basel), 2024, 17(1)108] | PubMed: 38256941 |
| Impact of sunitinib resistance on clear cell renal cell carcinoma therapeutic sensitivity in vitro [ Cell Cycle, 2024, 1-13.] | PubMed: 38263737 |
| Multi-omics and immunogenomics analysis revealed PFKFB3 as a targetable hallmark and mediates sunitinib resistance in papillary renal cell carcinoma: in silico study with laboratory verification [ Eur J Med Res, 2024, 29(1):236] | PubMed: 38622715 |
| Elucidation and Regulation of Tyrosine Kinase Inhibitor Resistance in Renal Cell Carcinoma Cells from the Perspective of Glutamine Metabolism [ Metabolites, 2024, 14(3)170] | PubMed: 38535330 |
POLITICA DI RESO
La politica di reso incondizionato di Selleck Chemical garantisce ai nostri clienti unesperienza di acquisto online senza problemi. Se non sei in alcun modo soddisfatto del tuo acquisto, puoi restituire qualsiasi articolo entro 7 giorni dalla ricezione. In caso di problemi di qualità del prodotto, sia relativi al protocollo che al prodotto, puoi restituire qualsiasi articolo entro 365 giorni dalla data di acquisto originale. Si prega di seguire le istruzioni seguenti per la restituzione dei prodotti.
SPEDIZIONE E CONSERVAZIONE
I prodotti Selleck vengono trasportati a temperatura ambiente. Se ricevi il prodotto a temperatura ambiente, ti assicuriamo che il Dipartimento di Ispezione Qualità di Selleck ha condotto esperimenti per verificare che la conservazione a temperatura normale per un mese non influirà sullattività biologica dei prodotti in polvere. Dopo la raccolta, conservare il prodotto secondo le indicazioni descritte nella scheda tecnica. La maggior parte dei prodotti Selleck è stabile nelle condizioni raccomandate.
NON PER USO UMANO, DIAGNOSTICO VETERINARIO O TERAPEUTICO.
