Dati tecnici
| Formula | C22H27FN4O2 |
||||||
| Peso molecolare | 398.47 | Numero CAS | 557795-19-4 | ||||
| Solubilità (25°C)* | In vitro | DMSO | 25 mg/mL (62.73 mM) | ||||
| Ethanol | 8 mg/mL (20.07 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Aggiungere i solventi al prodotto singolarmente e in ordine.) |
|
||||||
|
* <1 mg/ml significa leggermente solubile o insolubile. * Si prega di notare che Selleck testa la solubilità di tutti i composti internamente e la solubilità effettiva può differire leggermente dai valori pubblicati. Ciò è normale ed è dovuto a leggere variazioni da lotto a lotto. * Spedizione a temperatura ambiente (I test di stabilità mostrano che questo prodotto può essere spedito senza alcuna misura di raffreddamento.) |
|||||||
Preparazione delle soluzioni stock
Attività biologica
| Descrizione | Sunitinib è un inibitore RTK multitarget che agisce su VEGFR2 (Flk-1) e PDGFRβ con IC50 di 80 nM e 2 nM, e inibisce anche c-Kit. Sunitinib è anche un inibitore dose-dipendente dell'attività di autofosforilazione di IRE1α. Sunitinib induce autophagy e apoptosis. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Target |
|
||||||||
| In vitro | Sunitinib inibisce potentemente anche Kit e FLT-3. Questo composto è un potente inibitore competitivo dell'ATP di VEGFR2 (Flk1) e PDGFRβ con Ki di 9 nM e 8 nM, rispettivamente, mostrando una selettività >10 volte superiore per VEGFR2 e PDGFR rispetto a FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl e src. Nelle cellule NIH-3T3 private di siero che esprimono VEGFR2 o PDGFRβ, inibisce la fosforilazione di VEGFR2 VEGF-dipendente e la fosforilazione di PDGFRβ PDGF-dipendente con IC50 di 10 nM e 10 nM, rispettivamente. Questo composto chimico inibisce la proliferazione di HUVEC private di siero indotta da VEGF con IC50 di 40 nM e inibisce la proliferazione di cellule NIH-3T3 che sovraesprimono PDGFRβ o PDGFRα indotta da PDGF con IC50 di 39 nM e 69 nM, rispettivamente. Inibisce la fosforilazione di FLT3 wild-type, FLT3-ITD e FLT3-Asp835 con IC50 di 250 nM, 50 nM e 30 nM, rispettivamente. Questo inibitore inibisce la proliferazione delle cellule MV4;11 e OC1-AML5 con IC50 di 8 nM e 14 nM, rispettivamente, e induce apoptosi in modo dose-dipendente. | ||||||||
| In vivo | In accordo con la sostanziale e selettiva inibizione della fosforilazione e segnalazione di VEGFR2 o PDGFR in vivo, Sunitinib (20-80 mg/kg/die) mostra un'ampia e potente attività antitumorale dose-dipendente contro una varietà di modelli di xenotrapianto tumorale inclusi HT-29, A431, Colo205, H-460, SF763T, C6, A375 o MDA-MB-435. La somministrazione di questo composto a 80 mg/kg/die per 21 giorni porta a una regressione tumorale completa in sei su otto topi, senza ricrescita tumorale durante un periodo di osservazione di 110 giorni dopo la fine del trattamento. Un secondo ciclo di trattamento con questo composto rimane efficace contro i tumori che non sono regrediti completamente durante il primo ciclo di trattamento. Il trattamento con questo composto si traduce in una significativa diminuzione della MVD tumorale, con una riduzione di circa il 40% nei tumori di glioma SF763T. Il trattamento con SU11248 si traduce in un'inibizione completa della crescita tumorale aggiuntiva di xenotrapianti di PC-3M che esprimono luciferasi, nonostante l'assenza di riduzione delle dimensioni del tumore. Il trattamento con questo composto (20 mg/kg/die) sopprime drasticamente la crescita di xenotrapianti sottocutanei MV4;11 (FLT3-ITD) e prolunga la sopravvivenza nel modello di innesto di midollo osseo FLT3-ITD. |
Protocollo (da riferimento)
| Saggio della chinasi: |
|
|---|---|
| Saggio cellulare: |
|
| Studio sugli animali: |
|
Riferimenti
|
Convalida del prodotto da parte del cliente
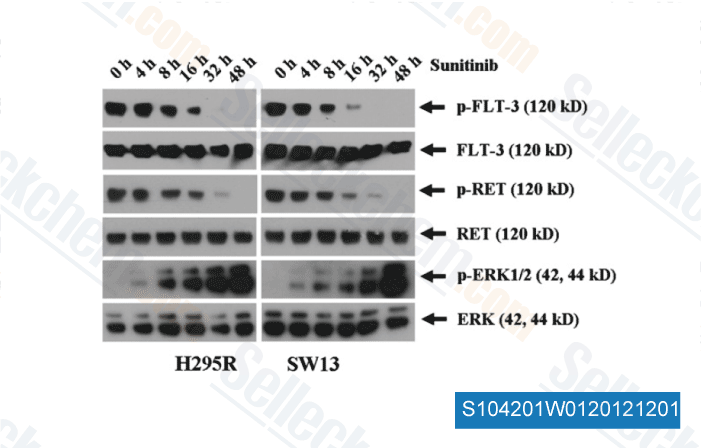
-
Dati da [ Surgery , 2012 , 152, 1045-50 ]
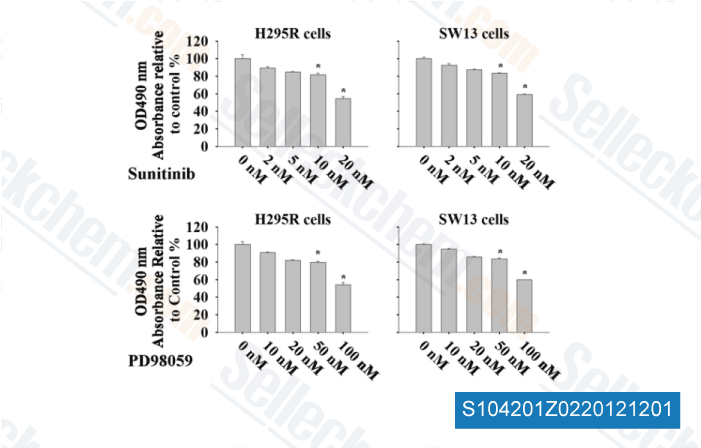
-
Dati da [ Surgery , 2012 , 152, 1045-50 ]
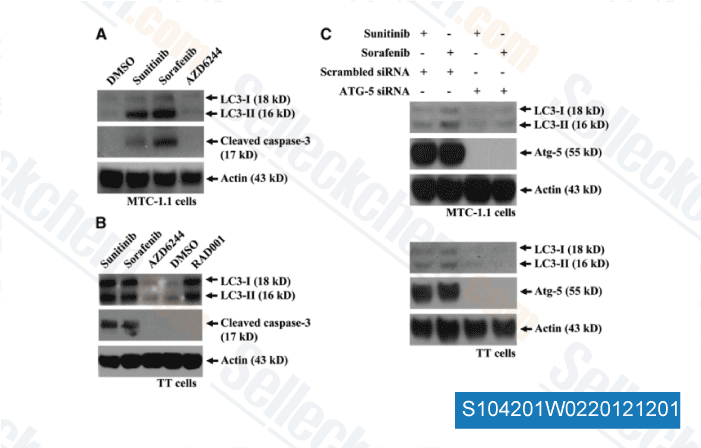
-
Dati da [ Surgery , 2012 , 152, 1142-9 ]
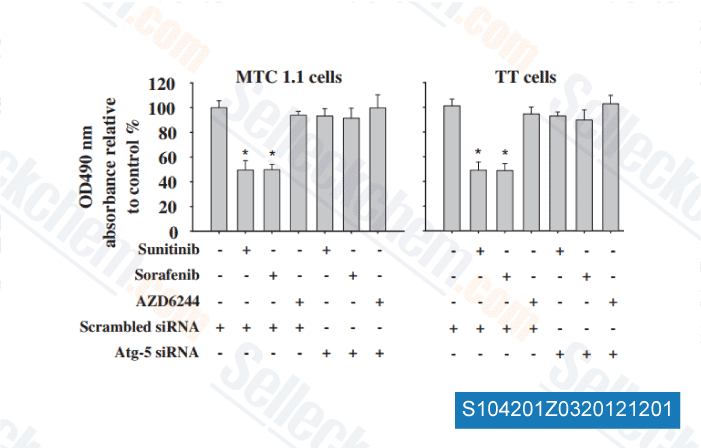
-
Dati da [ Surgery , 2012 , 152, 1142-9 ]
Sellecks Sunitinib (SU-11248) È stato citato da 257 Pubblicazioni
| Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups [ Cancer Cell, 2025, 43(4):776-796.e14] | PubMed: 40185092 |
| Single-cell multi-omics reveals that FABP1 + renal cell carcinoma drive tumor angiogenesis through the PLG-PLAT axis under fatty acid reprogramming [ Mol Cancer, 2025, 24(1):179] | PubMed: 40518526 |
| Multi-layer stratified oncology platform utilizing transcriptomics, prostate cancer organoids, and modeling of drug response [ J Exp Clin Cancer Res, 2025, 44(1):290] | PubMed: 41094672 |
| O-GlcNAcylation of UBAP2L regulates stress granule formation and sunitinib resistance in clear cell renal cell carcinoma [ J Exp Clin Cancer Res, 2025, 44(1):273] | PubMed: 41029457 |
| The novel hydrogen-PT2385-silncARSR nanocomplex impairs tumor angiogenesis and mitochondrial activity in sunitinib-resistant renal cancer [ Mater Today Bio, 2025, 35:102450] | PubMed: 41235366 |
| Unveiling the Anti-Angiogenic Potential of Small-Molecule (Kinase) Inhibitors for Application in Rheumatoid Arthritis [ Cells, 2025, 14(2)102] | PubMed: 39851530 |
| Baicalin reduces sunitinib-induced cardiotoxicity in renal carcinoma PDX model by inhibiting myocardial injury, apoptosis and fibrosis [ Front Pharmacol, 2025, 16:1563194] | PubMed: 40264678 |
| Kinomic profiling to predict sunitinib response of patients with metastasized clear cell Renal Cell Carcinoma [ Neoplasia, 2025, 60:101108] | PubMed: 39724752 |
| CYP1B1 promotes angiogenesis and sunitinib resistance in clear cell renal cell carcinoma via USP5-mediated HIF2α deubiquitination [ Neoplasia, 2025, 66:101186] | PubMed: 40435846 |
| Hyperpolarized [1-13C]pyruvate NMR spectroscopy reveals transition of tumor energy metabolism in microscale multicellular spheroids [ Sci Rep, 2025, 15(1):19303] | PubMed: 40456829 |
POLITICA DI RESO
La politica di reso incondizionato di Selleck Chemical garantisce ai nostri clienti unesperienza di acquisto online senza problemi. Se non sei in alcun modo soddisfatto del tuo acquisto, puoi restituire qualsiasi articolo entro 7 giorni dalla ricezione. In caso di problemi di qualità del prodotto, sia relativi al protocollo che al prodotto, puoi restituire qualsiasi articolo entro 365 giorni dalla data di acquisto originale. Si prega di seguire le istruzioni seguenti per la restituzione dei prodotti.
SPEDIZIONE E CONSERVAZIONE
I prodotti Selleck vengono trasportati a temperatura ambiente. Se ricevi il prodotto a temperatura ambiente, ti assicuriamo che il Dipartimento di Ispezione Qualità di Selleck ha condotto esperimenti per verificare che la conservazione a temperatura normale per un mese non influirà sullattività biologica dei prodotti in polvere. Dopo la raccolta, conservare il prodotto secondo le indicazioni descritte nella scheda tecnica. La maggior parte dei prodotti Selleck è stabile nelle condizioni raccomandate.
NON PER USO UMANO, DIAGNOSTICO VETERINARIO O TERAPEUTICO.
