réservé à la recherche
2-DG (2-Deoxy-D-glucose) Inhibiteur de la glycolyse
N° Cat.S4701
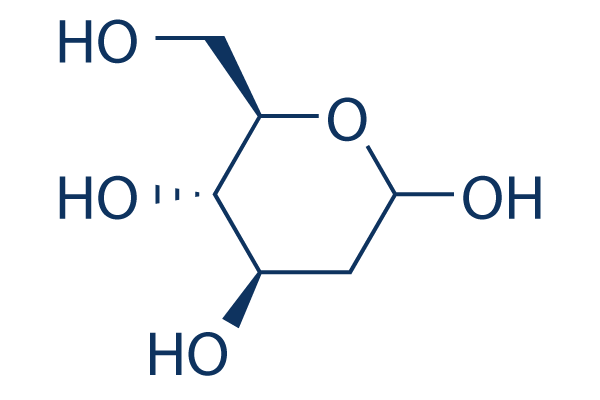
Structure chimique
Poids moléculaire: 164.16
Contrôle qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- Fiche technique
- SDS
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- Fiche technique
- SDS
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- Fiche technique
- SDS
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- Fiche technique
- SDS
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- Fiche technique
- SDS
| Cibles apparentées | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Mitochondrial Metabolism Drug Metabolite |
|---|---|
| Autre Carbohydrate Metabolism Inhibiteurs | Bromopyruvic acid (3-BP) Lonidamine Dorzagliatin LY2608204 Voglibose 1-Deoxynojirimycin 4',7-Dimethoxy-5-Hydroxyflavone AZD1656 Nodakenetin Kaempferol-3-O-neohesperidoside |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 164.16 | Formule | C6H12O5 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 154-17-6 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | 2-deoxyglucose, NSC 15193, 2-Deoxy-D-arabino-hexose, D-Arabino-2-deoxyhexose | Smiles | C(C=O)C(C(C(CO)O)O)O | ||
Solubilité
|
In vitro |
DMSO
: 500 mg/mL
(3045.8 mM)
Chauffé avec un bain-marie à 50°C;
Ultrasonifié;
Water : 83 mg/mL Ethanol : 8 mg/mL |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
glycolysis
|
|---|---|
| In vitro |
Le 2-Désoxy-D-glucose (2-DG) active la fonction AKT via la phosphatidylinositol 3-kinase (PI3K) et est indépendant de la glycolyse ou de l'inhibition de mTOR. Ses traitements perturbent la liaison entre le facteur de croissance analogue à l'insuline 1 (IGF-1) et la protéine de liaison à l'IGF 3 (IGFBP3) afin que la forme libre d'IGF-1 puisse être libérée du complexe IGF-1·IGFBP3 pour activer la signalisation du récepteur de l'IGF-1 (IGF1R). L'activation de nombreuses voies de survie induite par le 2-DG peut être conjointement atténuée par l'inhibition de l'IGF1R. Ce composé induit également une phosphorylation d'ERK dépendante du temps et de la dose. Il est facilement transporté dans les cellules et est phosphorylé par Hexokinase, mais ne peut pas être métabolisé davantage et s'accumule dans la cellule. Cela conduit à une déplétion d'ATP et à l'induction de la mort cellulaire. Le 2DG supprime significativement la prolifération, provoque l'Apoptosis related et réduit la migration des cellules endothéliales murines, inhibant la formation de lamellipodes et de filopodes et provoquant la désorganisation des filaments d'actine F dans les cellules endothéliales murines.
|
| In vivo |
Le traitement des patients atteints de cancer avec des doses relativement élevées de 2-Désoxy-D-glucose (2-DG) (supérieures à 200 mg/kg) a été largement inefficace pour gérer la croissance tumorale. Les effets secondaires de ce composé comprenaient des niveaux élevés de glucose dans le sang, une perte de poids progressive avec léthargie et des symptômes comportementaux d'hypoglycémie. Il améliore la perte du réflexe de redressement induite par l'isoflurane chez les souris. En réduisant le Metabolism, le traitement au 2-DG peut diminuer la température corporelle chez les rongeurs, augmentant ainsi la sensibilité aux anesthésiques. Un régime alimentaire le contenant a considérablement augmenté le niveau de corps cétoniques sériques et l'expression cérébrale des enzymes nécessaires au Metabolism des corps cétoniques. Le maintien de la bioénergétique mitochondriale induit par le 2-DG était parallèle à une réduction simultanée du stress oxydatif. De plus, les souris traitées ont montré une réduction significative des oligomères de la protéine précurseur amyloïde (APP) et de l'amyloïde bêta (Aβ), ce qui était parallèle à une augmentation significative de l'α-sécrétase et une diminution de l'expression de la γ-sécrétase, indiquant que ce composé induisait un déplacement vers une voie non amyloïdogénique. Il a augmenté l'expression des gènes impliqués dans les voies de clairance de l'Aβ, la dégradation, la séquestration et le transport. Concomitant avec une capacité bioénergétique accrue et une charge de β-amyloïde réduite, le 2-DG a significativement augmenté l'expression des facteurs de croissance neurotrophiques, BDNF et NGF, réduisant ainsi la pathologie dans un modèle murin femelle de la maladie d'Alzheimer.
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT02558140 | Completed | Neoplasms |
Hoffmann-La Roche |
October 11 2015 | Phase 1 |
| NCT01998841 | Completed | Alzheimer''s Disease |
Genentech Inc.|Banner Alzheimer''s Institute|National Institute on Aging (NIA) |
December 20 2013 | Phase 2 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
